题目内容
7.常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )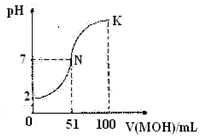
| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.HA溶液的物质的量浓度为0.01mol/L,根据图知,未加NaOH溶液时HA的pH=2;
C.HA是强酸,混合溶液呈中性时M(OH)体积为51mL,MOH过量,说明MOH是弱电解质,MA是强酸弱碱盐;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(M+)+c(H+)=c(OHˉ)+c(Aˉ),故A正确;
B.HA溶液的物质的量浓度为0.01mol/L,根据图知,未加NaOH溶液时HA的pH=2,溶液中c(H+)=c(HA),则HA是强电解质,为强酸,故B错误;
C.HA是强酸,混合溶液呈中性时M(OH)体积为51mL,MOH过量,说明MOH是弱电解质,MA是强酸弱碱盐,其水溶液呈酸性,pH<7,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,N点溶质为MA和及少量MOH,K点溶质为等物质的量的MA和MOH,N点促进水电离、K抑制水电离,故D错误;
故选A.
点评 本题以酸碱混合溶液定性判断为载体考查图象分析能力,为高频考点,侧重考查学生分析判断能力,正确判断酸碱强弱是解本题关键,题目难度不大.

练习册系列答案
相关题目
17.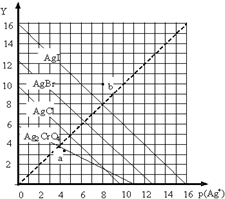 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
18.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
2.下列说法正确的是( )
| A. | 为测定氯水的pH,用滴管吸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
19.下列说法中正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | CCl4可用于鉴别溴水和碘水 | |
| C. | 漂白粉在空气中不稳定,因此可用于漂白纸张 | |
| D. | 用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 |
16.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )


| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1 g H2,消耗锌的质量65 g |
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: