题目内容
19.下列说法中正确的是( )| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | CCl4可用于鉴别溴水和碘水 | |
| C. | 漂白粉在空气中不稳定,因此可用于漂白纸张 | |
| D. | 用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 |
分析 A.NaClO是强电解质;
B.溴、碘在四氯化碳中的颜色不同;
C.漂白性与稳定性无关;
D.乙醇与水混溶,不能用于萃取.
解答 解:A.NaClO属于盐,是强电解质,故A错误;
B.溴、碘在四氯化碳中的颜色不同,可鉴别,故B正确;
C.漂白性与氧化性有关,与稳定性无关,故C错误;
D.萃取剂与水互不相溶,但乙醇与水混溶,不能用于萃取,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的鉴别、物质的性质以及物质的分离,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
10.2A(g)+B(g)?3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
7.常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )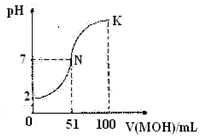

| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
4.加入HCl溶液后,溶液中离子数目会减少的是( )
| A. | CO32- | B. | Al3+ | C. | SO42- | D. | NO3- |
11.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、W在周期表的相对位置如图所示.X元素的最简单氢化物甲能使湿润的红色石蕊试纸变蓝,W元素是海水溶质中的一种主要的元素,X和Y同周期,Y与Z的最外层电子数之和与W的最外层电子数相等.请回答下列问题:
(1)W位于周期表中的位置第三周期第VIIA族.
(2)Z和W组成物质的电子式是 .
.
(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| X | |||
| W |
(2)Z和W组成物质的电子式是
 .
.(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.