题目内容
17.(1)己知反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O标况下生成3.36LNO,被还原的硝酸的物质的量为0.15mol,此时转移电子的物质的量为0.45mol.
(2)完成下列反应的离子方程式:
①碳酸氢钙溶液与少量的烧碱溶液反应:Ca2++HCO3-+OH-=H2O+CaCO3↓;
②石灰水和醋酸反应:CH3COOH+OH-=CH3COO-+H2O;
③向NaHSO4溶液中滴加入NaHCO3溶液:H++HCO3-=H2O+CO2↑;
④FeCl3溶液与氨水混合:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
⑤足置的CO2通入到氢氧化钙溶液中:CO2+OH-=HCO3-.
分析 (1)根据离子方程式的书写方法来书写离子方程式,在氧化还原反应中,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物,根据硝酸的作用以及方程式进行计算.
(2)①碳酸氢钙溶液与少量的烧碱溶液反应生成碳酸钙、碳酸氢钠和水;
②石灰水和醋酸反应生成醋酸钙和水;
③向NaHSO4溶液中滴加入NaHCO3溶液,反应生成硫酸钠和水、二氧化碳;
④FeCl3溶液与氨水混合反应生成氢氧化铁沉淀和氯化铵;
⑤足置的CO2通入到氢氧化钙溶液中,反应生成碳酸氢钙;
解答 解:(1)铜和硝酸反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,化合价降低元素的N元素所在的反应物HNO3是氧化剂,对应的产物NO是还原产物,在参加反应的8mool硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,当生成标况下3.36L即0.15molNO时,参加反应的硝酸的物质的量为0.6mol,其中被还原的硝酸的物质的量为0.15ml,此时转移电子的物质的量为0.15×3=0.45moL,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;NO;0.15;0.45;
(2))①碳酸氢钙溶液与少量的烧碱溶液反应生成碳酸钙、碳酸氢钠和水,离子方程式:Ca2++HCO3-+OH-=H2O+CaCO3↓;
故答案为:Ca2++HCO3-+OH-=H2O+CaCO3↓;
②石灰水和醋酸反应生成醋酸钙和水,离子方程式:CH3COOH+OH-=CH3COO-+H2O;
故答案为:CH3COOH+OH-=CH3COO-+H2O;
③向NaHSO4溶液中滴加入NaHCO3溶液,反应生成硫酸钠和水、二氧化碳,离子方程式:H++HCO3-=H2O+CO2↑;
故答案为:H++HCO3-=H2O+CO2↑;
④FeCl3溶液与氨水混合反应生成氢氧化铁沉淀和氯化铵,离子方程式:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
⑤足置的CO2通入到氢氧化钙溶液中,反应生成碳酸氢钙,离子方程式:CO2+OH-=HCO3-;
故答案为:CO2+OH-=HCO3-.
点评 本题考查了离子方程式的书写,氧化还原反应基本概念及计算,明确反应实质及氧化还原反应规律是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案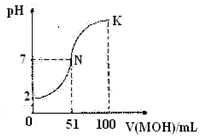
| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| A. | H2 | B. | AlCl3 | C. | CH4 | D. | H2SO4 |
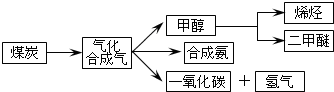
I.已知该产业链中某反应的平衡表达式为:K=$\frac{{c({H_2})•c({CO})}}{{c({H_2}O)}}$,它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g);
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=5.4mol/L.
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
②平衡时二甲醚的物质的量浓度是1.6mol/L.