题目内容
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )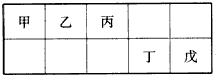

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:甲、乙、丙、丁、戊五种元素为短周期元素,则甲乙丙位于第2周期、丁戊位于第3周期;戊是同周期中原子半径最小的元素,同一周期中随着原子序数的递增,原子半径逐渐减小,则戊为Cl元素,丁为S元素、丙为N元素、乙为C元素、甲为B元素,根据元素周期律知识对各选项进行判断.
解答:
解:甲、乙、丙、丁、戊五种元素为短周期元素,则甲乙丙位于第2周期、丁戊位于第3周期;戊是同周期中原子半径最小的元素,同一周期中随着原子序数的递增,原子半径逐渐减小,则戊为Cl元素,丁为S元素、丙为N元素、乙为C元素、甲为B元素,
A.根据图示可知,按照甲、乙、丙、丁、戊的顺序,最外层电子数逐渐增多,即:甲<乙<丙<丁<戊,故A错误;
B.戊为Cl元素,丁为S元素、丙为N元素,其丙的离子含有2个电子层,戊、丁的离子含有三个电子层,由于戊的核电荷数大于丁,则三种元素对应的简单离子半径大小为:丁>戊>丙,故B错误;
C.丁为S元素,含有硫元素的酸有硫酸、亚硫酸及氢硫酸等,故C正确;
D.戊为Cl元素,丁为S元素、丙为N元素、乙为C元素,碳元素的氢化物有多种,Cl、S元素的氢化物有一种,而N的氢化物有多种,故D错误;
故选C.
A.根据图示可知,按照甲、乙、丙、丁、戊的顺序,最外层电子数逐渐增多,即:甲<乙<丙<丁<戊,故A错误;
B.戊为Cl元素,丁为S元素、丙为N元素,其丙的离子含有2个电子层,戊、丁的离子含有三个电子层,由于戊的核电荷数大于丁,则三种元素对应的简单离子半径大小为:丁>戊>丙,故B错误;
C.丁为S元素,含有硫元素的酸有硫酸、亚硫酸及氢硫酸等,故C正确;
D.戊为Cl元素,丁为S元素、丙为N元素、乙为C元素,碳元素的氢化物有多种,Cl、S元素的氢化物有一种,而N的氢化物有多种,故D错误;
故选C.
点评:本题考查了原子结构与元素周期律的知识,题目难度中等,注意掌握位置、结构与性质的关系,正确推断各元素名称为解答关键,“戊是同周期中原子半径最小的元素”为本题的突破口.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
在酸性溶液中,下列各组离子能大量共存的是( )
| A、Cl-、HCO3-、K+、SO42- |
| B、OH-、Cl-、Na+、Mg2+ |
| C、Fe3+、Na+、SO32-、I- |
| D、Na+、Cl-、I-、SO42- |
组成为
X的元素在周期表中的位置是( )
39 19 |
| A、第3周期第0族 |
| B、第4周期第ⅠA族 |
| C、第3周期第ⅠA族 |
| D、第3周期第ⅦA族 |
下列关于晶体的叙述错误的是( )
| A、分子晶体中可能不含共价键 |
| B、原子晶体中只存在共价键 |
| C、离子晶体中一定含有离子键 |
| D、分子晶体中可能含有离子键 |
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)?E(g).当反应进行到4min时达到平衡,测得M的浓度为0.2mol/L.下列说法正确的是( )
| A、4min时,M的转化率为80% |
| B、4min时,用M表示的化学反应速率为0.8mol/(L?min) |
| C、4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D、4min时,E的物质的量浓度为1.6mol/L |