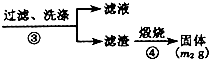
题目内容
在酸性溶液中,下列各组离子能大量共存的是( )
| A、Cl-、HCO3-、K+、SO42- |
| B、OH-、Cl-、Na+、Mg2+ |
| C、Fe3+、Na+、SO32-、I- |
| D、Na+、Cl-、I-、SO42- |
考点:离子共存问题
专题:
分析:酸性溶液中含大量的H+,根据离子之间不能结合生成水、气体、沉淀等,不发生氧化还原反应等,则离子能大量共存,以此来解答.
解答:
解:A.酸性条件下HCO3-不能大量共存,生成二氧化碳和水,故A错误;
B.OH-与H+反应生成水,且与Mg2+反应生成沉淀,不能大量共存,故B错误;
C.酸性条件下Fe3+与SO32-、I-发生氧化还原反应,不能大量共存,故C错误;
D.酸性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.OH-与H+反应生成水,且与Mg2+反应生成沉淀,不能大量共存,故B错误;
C.酸性条件下Fe3+与SO32-、I-发生氧化还原反应,不能大量共存,故C错误;
D.酸性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握常见离子的性质以及反应类型的判断,答题时注意溶液呈酸性的特点,难度不大.

练习册系列答案
相关题目
下列事实得出的结论正确的是( )
| A、某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO2 |
| B、用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体 |
| C、常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼 |
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |
在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
| A、Cu2+、K+、Cl-、NO3- |
| B、Ag+、Na+、Cl-、NO3- |
| C、Mg2+、Al3+、SO42-、Cl- |
| D、Ba2+、NH4+、Cl-、HCO3- |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )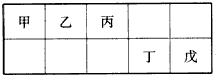

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |

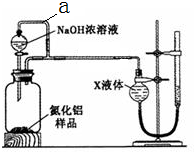 氮化铝(AlN)是一种新型无机材料.
氮化铝(AlN)是一种新型无机材料.