题目内容
将5.6g的金属Fe投入到100mL某浓度的稀盐酸中,两者恰好完全反应.完成以下计算:
(1)5.6g Fe的物质的量;
(2)生成的H2的体积(标准状况下);
(3)稀盐酸的浓度.
(1)5.6g Fe的物质的量;
(2)生成的H2的体积(标准状况下);
(3)稀盐酸的浓度.
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算Fe的物质的量;发生反应:Fe+2HCl=FeCl2+H2↑,根据方程式计算HCl、氢气的物质的量,再根据V=nVm计算氢气体积,根据c=
计算盐酸的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:(1)5.6g Fe的物质的量为
=0.1mol,
答:5.6g Fe的物质的量为0.1mol;
(2)设生成氢气物质的量为n,则:
Fe+2HCl=FeCl2+H2↑
1 1
0.1mol n
所以n=0.1mol,故氢气体积为0.1mol×22.4L/mol=2.24L,
答:标况下氢气体积为2.24L;
(3)设HCl的物质的量为x,则:
Fe+2 HCl=FeCl2+H2↑
1 2
0.1mol x
所以x=0.2mol,故盐酸的物质的量浓度为
=2mol/L,
答:盐酸的浓度为2mol/L.
| 5.6g |
| 56g/mol |
答:5.6g Fe的物质的量为0.1mol;
(2)设生成氢气物质的量为n,则:
Fe+2HCl=FeCl2+H2↑
1 1
0.1mol n
所以n=0.1mol,故氢气体积为0.1mol×22.4L/mol=2.24L,
答:标况下氢气体积为2.24L;
(3)设HCl的物质的量为x,则:
Fe+2 HCl=FeCl2+H2↑
1 2
0.1mol x
所以x=0.2mol,故盐酸的物质的量浓度为
| 0.2mol |
| 0.1L |
答:盐酸的浓度为2mol/L.
点评:本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
苹果切开后的剖面在空气中会很快变黄,有人称之为“苹果生锈”.若将维生素C溶液涂在新切开的剖面上,剖面就不会迅速变成黄色.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、碱性 | D、酸性 |
下列事实得出的结论正确的是( )
| A、某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO2 |
| B、用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体 |
| C、常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼 |
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
下列原子的电子排布式能表示基态原子的电子排布式的是( )
| A、[Ne]3s13p3 |
| B、[Ar]3d64s1 |
| C、[Ar]3d64s2 |
| D、[Ne]3s23p63d5 |
根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
| A、1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(i)的产物比反应(ii)的产物稳定 |
| D、反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
下列说法正确的是( )
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,28g的N2体积约为22.4L |
设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )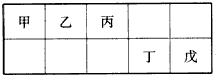

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
