题目内容
A、B、C、D为原子序数由小到大排列的四种短周期元素,已知:
①A原子最外电子层的p能级填充了2个电子;
②B元素形成的单质占空气体积的20%左右;D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于B元素.
③C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6
请回答:
(1)A元素原子价电子排布式为 ,A的氢化物中分子构型为正四面体的是(填名称) .
(2)C2B2为 晶体.
(3)AB2与C的最高价氧化物的水化物以物质的量比值为1:1反应的离子方程式为 .
(4)A、B、C、D四种元素的第一电离能由大到小的顺序是 .
(5)处理含A的低价氧化物AO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质硫.
已知:2AO(g)+O2(g)═2AO2(g)△H=-566.0kJ?mol-1
S(s)+O2(g)═SO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是 .
①A原子最外电子层的p能级填充了2个电子;
②B元素形成的单质占空气体积的20%左右;D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于B元素.
③C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6
请回答:
(1)A元素原子价电子排布式为
(2)C2B2为
(3)AB2与C的最高价氧化物的水化物以物质的量比值为1:1反应的离子方程式为
(4)A、B、C、D四种元素的第一电离能由大到小的顺序是
(5)处理含A的低价氧化物AO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质硫.
已知:2AO(g)+O2(g)═2AO2(g)△H=-566.0kJ?mol-1
S(s)+O2(g)═SO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:B元素形成的单质占空气体积的20%左右,则B为O元素;
A原子最外电子层的p能级填充了2个电子,原子序数小于O元素,则A为C元素;
C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6,则C为Na元素;
D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于O元素,原子序数大于Na,则D为Cl,
根据以上分析可知,A、B、C、D分别为:C、O、Na、Cl,据此进行解答.
A原子最外电子层的p能级填充了2个电子,原子序数小于O元素,则A为C元素;
C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6,则C为Na元素;
D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于O元素,原子序数大于Na,则D为Cl,
根据以上分析可知,A、B、C、D分别为:C、O、Na、Cl,据此进行解答.
解答:
解:B元素形成的单质占空气体积的20%左右,则B为O元素;
A原子最外电子层的p能级填充了2个电子,原子序数小于O元素,则A为C元素;
C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6,则C为Na元素;
D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于O元素,原子序数大于Na,则D为Cl,
根据以上分析可知,A、B、C、D分别为:C、O、Na、Cl,
(1)A为C元素,C元素原子价电子排布式为:2s22p2;碳元素形成的氢化物中,分子构型为正四面体结构的是甲烷,
故答案为:2s22p2;甲烷;
(2)元素B、C分别为O、Na,则C2B2为过氧化钠,Na2O2含有离子键,属于离子晶体,故答案为:离子;
(3)A、B、C分别为:C、O、Na,CO2与NaOH以物质的量比值为1:1反应得到的是NaHCO3,反应的离子方程式为:CO2+OH-=HCO3-,
故答案为:CO2+OH-=HCO3-;
(4)第一电离能与元素的非金属性关系规律而:第一电离能越大,元素的非金属性越大,则A、B、C、D四种元素的第一电离能由大到小的顺序是:O>Cl>C>Na,
故答案为:O>Cl>C>Na;
(5)A为碳元素,①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
②S(s)+O2(g)═SO2(g)△H=-296.0kJ?mol-1,
根据盖斯定律,①-②可得:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ?mol-1.
A原子最外电子层的p能级填充了2个电子,原子序数小于O元素,则A为C元素;
C元素容易失去最外层的1个电子形成离子的电子排布式为1s22s22p6,则C为Na元素;
D元素的基态原子电子排布中,p轨道上只有1个未成对电子,电负性略小于O元素,原子序数大于Na,则D为Cl,
根据以上分析可知,A、B、C、D分别为:C、O、Na、Cl,
(1)A为C元素,C元素原子价电子排布式为:2s22p2;碳元素形成的氢化物中,分子构型为正四面体结构的是甲烷,
故答案为:2s22p2;甲烷;
(2)元素B、C分别为O、Na,则C2B2为过氧化钠,Na2O2含有离子键,属于离子晶体,故答案为:离子;
(3)A、B、C分别为:C、O、Na,CO2与NaOH以物质的量比值为1:1反应得到的是NaHCO3,反应的离子方程式为:CO2+OH-=HCO3-,
故答案为:CO2+OH-=HCO3-;
(4)第一电离能与元素的非金属性关系规律而:第一电离能越大,元素的非金属性越大,则A、B、C、D四种元素的第一电离能由大到小的顺序是:O>Cl>C>Na,
故答案为:O>Cl>C>Na;
(5)A为碳元素,①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
②S(s)+O2(g)═SO2(g)△H=-296.0kJ?mol-1,
根据盖斯定律,①-②可得:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ?mol-1.
点评:本题考查了位置结构与性质的关系、热化学方程式的书写、第一电离能大小判断等知识,题目难度中等,注意掌握原子结构与元素周期律、元素周期表的关系,明确盖斯定律、第一电离能的概念及应用方法,试题有利于培养学生的分析、理解能力.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
| A、1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(i)的产物比反应(ii)的产物稳定 |
| D、反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )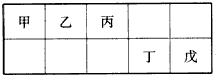

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
下列物质中属于电解质的是( )
①氢氧化钠 ②硫酸钡 ③铜 ④酒精 ⑤氯水.
①氢氧化钠 ②硫酸钡 ③铜 ④酒精 ⑤氯水.
| A、①② | B、①②⑤ | C、③④ | D、①⑤ |
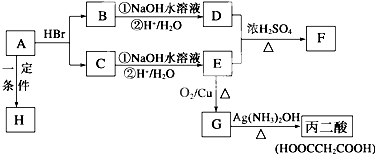
 如图是某种只含有C、H、O、N的有机物简易球棍模型.请回答下列各题.
如图是某种只含有C、H、O、N的有机物简易球棍模型.请回答下列各题.