题目内容
下列关于晶体的叙述错误的是( )
| A、分子晶体中可能不含共价键 |
| B、原子晶体中只存在共价键 |
| C、离子晶体中一定含有离子键 |
| D、分子晶体中可能含有离子键 |
考点:分子晶体,离子晶体,原子晶体
专题:化学键与晶体结构
分析:A.分子晶体中可能不含共价键,如稀有气体;
B.原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体;
C.离子晶体指的是阴阳离子通过离子键结合形成的晶体;
D.含有离子键的一定是离子晶体.
B.原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体;
C.离子晶体指的是阴阳离子通过离子键结合形成的晶体;
D.含有离子键的一定是离子晶体.
解答:
解:A.分子晶体中可能不含共价键,如稀有气体,故A正确;
B.原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故原子晶体中只存在共价键,故B正确;
C.离子晶体指的是阴阳离子通过离子键结合形成的晶体,故离子晶体中一定含有离子键,故C正确;
D.含有离子键的一定是离子晶体,故分子晶体中不可能含有离子键,故D错误;
故选D.
B.原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故原子晶体中只存在共价键,故B正确;
C.离子晶体指的是阴阳离子通过离子键结合形成的晶体,故离子晶体中一定含有离子键,故C正确;
D.含有离子键的一定是离子晶体,故分子晶体中不可能含有离子键,故D错误;
故选D.
点评:本题考查晶体的构成,难度中等.要注意掌握原子晶体、离子晶体及分子晶体的构成粒子及性质.

练习册系列答案
相关题目
设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )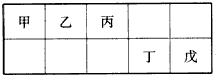

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
下列物质中属于电解质的是( )
①氢氧化钠 ②硫酸钡 ③铜 ④酒精 ⑤氯水.
①氢氧化钠 ②硫酸钡 ③铜 ④酒精 ⑤氯水.
| A、①② | B、①②⑤ | C、③④ | D、①⑤ |
区分胶体与溶液的依据是( )
| A、分散质直径大小 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质粒子是否带电 |
常温下,纯水中存在电离平衡:H2O?H++OH-.欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
| A、FeCl3 |
| B、H2SO4 |
| C、NaHCO3 |
| D、NaOH |
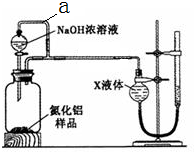 氮化铝(AlN)是一种新型无机材料.
氮化铝(AlN)是一种新型无机材料.