题目内容
NH3是一种重要的化工产品,是制造铵盐的原料.
(1)实验室用图1所示装置制备氨气,该反应的化学反应方程式为 .检验氨气的方法是 .
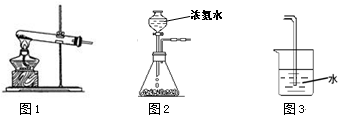
(2)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是 (填字母序号).
a.锥形瓶中加入的固体物质可以是碱石灰
b.制得的氨气可用碱石灰来干燥
c.可用图3装置和试剂对氨气进行尾气处理
(3)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是 .
(4)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇(CH3OH)反应制取一氯甲烷(CH3Cl),该反应的化学方程式为 .
(5)工业合成氨:N2+3H2
2NH3.已知断开1mol化学键所需的能量见表.
则运用键能数据计算,该反应的△H约为 kJ?mol-1.
(1)实验室用图1所示装置制备氨气,该反应的化学反应方程式为

(2)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是
a.锥形瓶中加入的固体物质可以是碱石灰
b.制得的氨气可用碱石灰来干燥
c.可用图3装置和试剂对氨气进行尾气处理
(3)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是
(4)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇(CH3OH)反应制取一氯甲烷(CH3Cl),该反应的化学方程式为
(5)工业合成氨:N2+3H2
| ||
| 高温高压 |
| N≡N | H-H | N-H | |
| 键能/kJ?mol-1 | 945 | 436 | 391 |
考点:氨的制取和性质
专题:氮族元素
分析:(1)图1为实验室制备氨气的反应装置,可以用氢氧化钙与氯化铵加热反应完成;根据实验室中常用的检验氨气的方法解答;
(2)根据碱石灰能够吸水、增大氢氧根离子浓度及氨气的化学性质进行解答;
(3)氯化铵溶液中,铵根离子部分水解,溶液显示酸性;
(4)根据题中信息判断反应物、生成物、反应条件,然后写出反应的化学方程式;
(5)根据热化学方程式的焓变△H=断裂反应物中旧化学式吸收总能量-形成生成物中新化学键放出总能量,据此进行计算.
(2)根据碱石灰能够吸水、增大氢氧根离子浓度及氨气的化学性质进行解答;
(3)氯化铵溶液中,铵根离子部分水解,溶液显示酸性;
(4)根据题中信息判断反应物、生成物、反应条件,然后写出反应的化学方程式;
(5)根据热化学方程式的焓变△H=断裂反应物中旧化学式吸收总能量-形成生成物中新化学键放出总能量,据此进行计算.
解答:
解:(1)实验室制备氨气的方法是加热氯化铵和熟石灰的固体混合物,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
检验氨气的方法有:方法一:用湿润的红色石蕊试纸检测气体,试纸变蓝,说明气体是氨气,方法二:用一根玻璃棒蘸取浓盐酸,靠近气体,有大量白烟,说明气体是氨气,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸检测气体,试纸变蓝,说明气体是氨气(或用一根玻璃棒蘸取浓盐酸,靠近气体,有大量白烟,说明气体是氨气);
(2)a.碱石灰可以吸收浓氨水中水分、增大氢氧根离子浓度,有利于氨气放出,所以锥形瓶中可以盛放碱石灰,故A正确;
b.氨气为碱性气体,可以用碱石灰干燥氨气;
c.氨气极易溶于水,尾气吸收装置必须具有防止倒吸的作用,故C错误;
故答案为:ab;
(3)铵根离子水解,溶液显示酸性,水解方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+;
(4)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇反应制取一氯甲烷,该反应的化学方程式为:NH4Cl+CH3OH
CH3Cl+NH3↑+H2O,
故答案为:NH4Cl+CH3OH
CH3Cl+NH3↑+H2O;
(5)反应N2+3H2?2NH3中,断裂旧化学键吸收总量为:(945×1+436×3)k/mol=2253kJ/mol,
形成氨气放出的总能量为:391kJ/mol×3×2=2346kJ./mol,
该反应的焓变△H=2253kJ/mol-2346kJ/mol=-93kJ/mol,
故答案为:-93.
| ||
检验氨气的方法有:方法一:用湿润的红色石蕊试纸检测气体,试纸变蓝,说明气体是氨气,方法二:用一根玻璃棒蘸取浓盐酸,靠近气体,有大量白烟,说明气体是氨气,
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)a.碱石灰可以吸收浓氨水中水分、增大氢氧根离子浓度,有利于氨气放出,所以锥形瓶中可以盛放碱石灰,故A正确;
b.氨气为碱性气体,可以用碱石灰干燥氨气;
c.氨气极易溶于水,尾气吸收装置必须具有防止倒吸的作用,故C错误;
故答案为:ab;
(3)铵根离子水解,溶液显示酸性,水解方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+;
(4)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇反应制取一氯甲烷,该反应的化学方程式为:NH4Cl+CH3OH
| ||
| 280~450℃ |
故答案为:NH4Cl+CH3OH
| ||
| 280~450℃ |
(5)反应N2+3H2?2NH3中,断裂旧化学键吸收总量为:(945×1+436×3)k/mol=2253kJ/mol,
形成氨气放出的总能量为:391kJ/mol×3×2=2346kJ./mol,
该反应的焓变△H=2253kJ/mol-2346kJ/mol=-93kJ/mol,
故答案为:-93.
点评:本题考查了氨气的制备原理、反应热的计算、化学方程式书写等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,28g的N2体积约为22.4L |
在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
| A、Cu2+、K+、Cl-、NO3- |
| B、Ag+、Na+、Cl-、NO3- |
| C、Mg2+、Al3+、SO42-、Cl- |
| D、Ba2+、NH4+、Cl-、HCO3- |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )

| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
在一定温度下向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应X(g)+Y(g)?2Z(g),此反应达到平衡的标志是( )
| A、容器内压强不随时间变化 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:1:2 |
| D、单位时间内消耗0.1 mol X同时生成0.2 mol Z |
区分胶体与溶液的依据是( )
| A、分散质直径大小 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质粒子是否带电 |
关于分子或离子中心原子的杂化轨道类型和空间构型,下列判断正确的是( )
| A、PH3、sp2平面三角形 |
| B、SO32-、sp2 平面三角形 |
| C、NO3-、sp3 三角锥形 |
| D、SO2、sp2V形 |