题目内容
已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元素,B元素的原子核外M层上的电子数比K层上的电子数多1.回答下列问题:
(1)A原子的结构示意图为 ;A元素位于周期表的第 周期、第 族.
(2)A和C形成的化合物的电子式为 ,该化合物的水溶液呈 性(填“酸”或“碱”).
(3)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式 .
(1)A原子的结构示意图为
(2)A和C形成的化合物的电子式为
(3)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为40,故C的原子序数为40-11-13=16,故C为S元素,据此答题;
解答:
解:A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为40,故C的原子序数为40-11-13=16,故C为S元素
(1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为 ;Na元素在周期表中位置为第三周期第ⅠA族.
;Na元素在周期表中位置为第三周期第ⅠA族.
故答案为: ;三;ⅠA.
;三;ⅠA.
(2)A和C形成的化合物是Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为 ;硫化钠溶液中硫离子水解,使溶液呈碱性.
;硫化钠溶液中硫离子水解,使溶液呈碱性.
故答案为: ;碱.
;碱.
(3)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为
 ;Na元素在周期表中位置为第三周期第ⅠA族.
;Na元素在周期表中位置为第三周期第ⅠA族.故答案为:
 ;三;ⅠA.
;三;ⅠA.(2)A和C形成的化合物是Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为
 ;硫化钠溶液中硫离子水解,使溶液呈碱性.
;硫化钠溶液中硫离子水解,使溶液呈碱性.故答案为:
 ;碱.
;碱.(3)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题主要考查了原子结构示意图、电子式、离子反应等知识点,难度 不大,解题的关键是元素推断,答题时注意化学用语的规范表达.

练习册系列答案
相关题目
1L浓度为1mol/L的FeCl3溶液与3L 1mol/L的KCl溶液中Cl-物质的量浓度之比为( )
| A、3:2 | B、1:1 |
| C、3:1 | D、1:3 |
A、B、C、D四种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍.下列说法正确的是( )
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
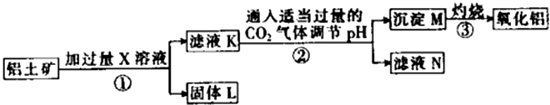

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
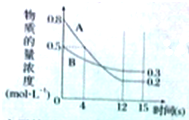 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.