题目内容
3.将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀,如果加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,假设完全反应(不考虑体积变化),请求(1)生成的沉淀的最大值是多少?
(2)原合金中Mg的质量百分含量(计算结果保留一位小数点).
分析 (1)加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,
由Mg$\stackrel{2HCl}{→}$MgCl2$\stackrel{2NaOH}{→}$Mg(OH)2,Al$\stackrel{3HCl}{→}$AlCl3$\stackrel{3NaoH}{→}$Al(OH)3,根据关系式计算;
(2)设出合金中镁、铝的物质的量,分别根据合金质量、设出沉淀的质量列式计算.
解答 解:加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,
即所用NaOH溶液的体积为800ml-400ml=400ml=0.4L,所以n(NaOH)=0.4L×1mol/L=0.4mol,
(1)根据Mg$\stackrel{2HCl}{→}$MgCl2$\stackrel{2NaOH}{→}$Mg(OH)2、Al$\stackrel{3HCl}{→}$AlCl3$\stackrel{3NaoH}{→}$Al(OH)3可知:3.9gMg、Al合金最终得到的是Mg(OH)2和Al(OH)3沉淀,
且满足:沉淀的质量m(氢氧化物)=m(合金)+m(OH-),
根据转化关系式可知:n(OH-)=n(NaOH)=0.4mol,则m(OH-)=0.4mol×17g/mol=6.8g,
所以沉淀的质量为:m(氢氧化物)=m(合金)+m(OH-)=3.9g+6.8g=10.7g,
答:生成的沉淀的最大值是10.7g;
(2)设3.9gMg、Al合金中Mg的物质的量为x,Al的物质的量为y,则:24x+27y=3.9、58x+78y=10.7,
解得:x=0.05mol、y=0.1mol,
即:镁、铝的物质的量分别为0.05mol、0.1mol,
所以Mg的质量为:0.05mol×24g/mol=1.2g,
原合金中Mg的质量百分含量为:$\frac{1.2g}{3.9g}$=30.8%,
答:原合金中Mg的质量百分含量为30.8%.
点评 本题考查混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意关系式法和守恒法在解答中的重要应用,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 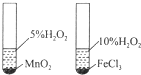 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 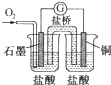 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是防止Fe2+水解.
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是冷却结晶,洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(4)“沉淀2”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净
(5)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤
【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,使C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉,加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
| A. | CO32-→CO2 | B. | Na→Na2O | C. | KMnO4→MnO2 | D. | SO2→S |
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2HCl$\frac{\underline{\;通电\;}}{\;}$Cl2+H2 |
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
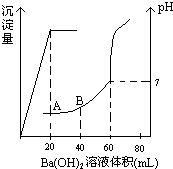 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求: