题目内容
12.在25℃,101kPa下,写出下列反应的热化学方程式:(1)1mol N2(g)与适量O2(g)起反应生成NO2(g),吸收68kJ热量N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1
(2)1g甲烷完全燃烧放出55.6kJ热量,写出表示CH4(g)燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
(3)已知P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ/mol
P(s、红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s);△H=-738.5kJ/mol
试写出白磷转化为红磷的热化学方程式P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1.
分析 (1)1mol N2 (g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1;
(2)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出;
(3)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ•mol-1 ①,
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1,由此分析解答.
解答 解:(1)1mol N2 (g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1;
(2)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol;
(3)红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:P4O10(s)=P4(s、白磷)+5O2(g);△H=2983.2kJ•mol-1
;4P(s、红磷)+5O2(g)=P4O10(s);△H=-738.5×4kJ•mol-1=-2954kJ•mol-1;
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1,故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1.
点评 本题考查了热化学方程式的书写,难度不大,注意掌握热化学方程式的书写规则.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案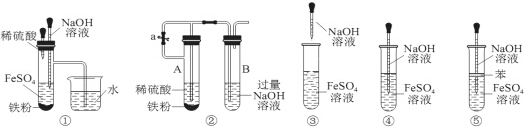
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ①②③④ | D. | ②④⑤ |
| A. | Ca2(OH)(PO4)3 | B. | Ca3(OH)(PO4)3 | C. | Ca4(OH)(PO4)3 | D. | Ca5(OH)(PO4)3 |
 已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )
已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )①CO2、NaOH溶液;②Ca(HCO3)2溶液、Ca(OH)2溶液;③Na、O2;
④CuO、C;⑤AlCl3溶液、NH3•H2O ⑥NaAlO2溶液、盐酸.
| A. | ①③⑤ | B. | ①④⑤ | C. | ①④⑥ | D. | ①②⑥ |
| A. | 23gNa在空气中加热完全变成Na2O2时失去2NA个电子 | |
| B. | 标准状况下,22.4LH2含有NA个H2分子 | |
| C. | 1mol/L的硝酸钠溶液中含有的硝酸根离子数为NA | |
| D. | 0.5molKClO3中含有ClO3-的数目为NA |
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| A. | C2H6O和C3H8 | B. | CH4和C3H6 | C. | C3H6和C3H8 | D. | CH4和C2H2 |