题目内容
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
分析 A.使甲基橙呈红色的溶液呈酸性;
B.由水电离出C(H+)=1×10-14溶液,水的电离受到抑制,可能呈酸性或碱性;
C.$\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液呈酸性;
D.与Fe3+反应的离子不能大量共存.
解答 解:A.使甲基橙呈红色的溶液呈酸性,酸性条件下OH-、AlO2-不能大量共存,故A错误;
B.由水电离出C(H+)=1×10-14溶液,水的电离受到抑制,可能呈酸性或碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.$\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液呈酸性,离子之间不发生任何反应,可大量共存,故C正确;
D.SCN-与Fe3+发生络合反应而不能大量共存,故D错误.
故选C.
点评 本题考查了离子共存,为高频考点,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.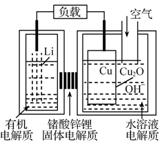 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
10.下列根据实验操作和现象所得到的结论正确的是.
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验现象描述正确的是( )
| A. | 红热的铜丝在硫蒸汽中燃烧,产生黑色固体 | |
| B. | 碘水中加入少量CCl4,振荡静置后,下层颜色变浅,上层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生白色的烟 |
8.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增a g,则该物质为( )
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
9.关于如图所示的过程,下列说法不正确的是( )
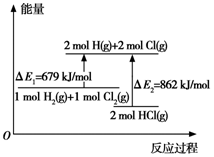

| A. | △E1是该反应的活化能 | B. | △E2是2 mol H-Cl键的总键能 | ||
| C. | 加入催化剂可以改变反应的焓变 | D. | 该反应是一个放热反应 |

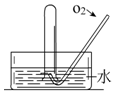 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.