题目内容
7.某化学课外小组利用图1装置探究SO2的性质.
请回答下列问题:
(1)装置甲中A仪器的名称是分液漏斗.
(2)装置乙中出现的现象是溶液褪色,可以证明SO2具有b(填代号).装置丙中发生反应的化学方程式为2H2S+SO2=3S↓+2H2O,可以证明SO2具有a(填代号).
a.氧化性 b.还原性 c.漂自性
(3)收集SO2气体可以选择的装置如图2为ac(填代号).从环保的角度考虑,收集装置的出气口需要连接一个盛有NaOH(填化学式)溶液的洗气瓶.
分析 (1)根据仪器的特点确定仪器的名称;
(2)二氧化硫具有还原性,能使高锰酸钾褪色,还具有氧化性,能和氢硫酸之间反应得到单质硫;
(3)二氧化硫的密度大于空气,就可选择向上排空气法收集,具有毒性,要进行尾气处理.
解答 解:(1)根据仪器的特点知道仪器A的名称是分液漏斗,故答案为:分液漏斗;
(2)高锰酸钾具有强氧化性,二氧化硫具有还原性,能使高锰酸钾溶液褪色,能和氢硫酸之间反应得到单质硫,反应为2H2S+SO2=3S↓+2H2O,体现二氧化硫的氧化性,
故答案为:溶液褪色;b;2H2S+SO2=3S↓+2H2O;a;
(3)二氧化硫的密度大于空气,就可选择向上排空气法,收集收集SO2气体可以选择的装置为ac,二氧化硫具有毒性,要进行尾气处理,可以用氢氧化钠来吸收,
故答案为:ac;NaOH.
点评 本题是一道考查学生二氧化硫性质的实验方案设计题,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
16.FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性.
I.实验室制备FeBr2
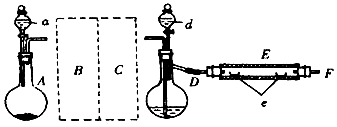
实验室用如图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中盛有细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在E管的一端有黄绿色鳞片状溴化亚铁.
请回答:
(1)仪器D的名称是蒸馏烧瓶.给D加热最好选择下列加热器中的b.

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为盛有饱和NaHCO3溶液的洗气瓶,C为盛有浓H2SO4的洗气瓶.为防止污染空气,实验时应在F处连接盛有碱性溶液的尾气吸收装置.
(3)实验时,装置D和E的橡胶塞最好用铝箔包住,且连接D、E之间的橡胶管尽可能短的原因是Br2有腐蚀性,腐蚀橡胶塞.
(4)①E管反应前先通入一段时间CO2,其主要作用是排净容器里的空气;
②反应过程中要继续通入CO2,其主要作用是将Br2蒸气带入反应器中.
II.探究FeBr2的还原性
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
(5)现象i中溶液由浅绿色逐渐变黄.某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色.请设计实验证明现象i中溶液由浅绿色变黄色的原因是原因①还是原因②:取5mL上述黄色溶液于试管中,向该溶液中加入KSCN溶液,溶液变为红色,说明原因①对,否则不成立;取5mL上述黄色溶液于试管中,向其中滴加少量四氯化碳,震荡,若CCl4层呈橙红色,说明原因②对,否则不成立.
(6)若向上述FeBr2溶液中通入224mL Cl2(标准状况),则反应的离子方程式为2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
I.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中盛有细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在E管的一端有黄绿色鳞片状溴化亚铁.

请回答:
(1)仪器D的名称是蒸馏烧瓶.给D加热最好选择下列加热器中的b.

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为盛有饱和NaHCO3溶液的洗气瓶,C为盛有浓H2SO4的洗气瓶.为防止污染空气,实验时应在F处连接盛有碱性溶液的尾气吸收装置.
(3)实验时,装置D和E的橡胶塞最好用铝箔包住,且连接D、E之间的橡胶管尽可能短的原因是Br2有腐蚀性,腐蚀橡胶塞.
(4)①E管反应前先通入一段时间CO2,其主要作用是排净容器里的空气;
②反应过程中要继续通入CO2,其主要作用是将Br2蒸气带入反应器中.
II.探究FeBr2的还原性
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
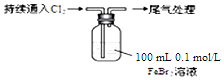 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(6)若向上述FeBr2溶液中通入224mL Cl2(标准状况),则反应的离子方程式为2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
18.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 合成酚醛树脂的单体是苯酚和甲醇 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | 塑料、合成纤维和合成橡胶都属于合成材料 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
12.甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l 则甲烷的燃烧热为( )
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l 则甲烷的燃烧热为( )
| A. | 846.3 kJ•mol-l | B. | 758.3 kJ•mol-l | C. | 890.3 kJ•mol-l | D. | 714.3 kJ•mol-l |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
16.下列有关NaHCO3与Na2CO3的说法中不正确的是( )
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 与酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| C. | 热稳定性:Na2CO3>NaHCO3 | |
| D. | 二者间在一定条件下可相互转化 |
17.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
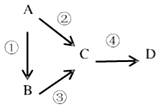 A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.