题目内容
8.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增a g,则该物质为( )| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
分析 C、H、O化合物在氧气作用下,固体过氧化钠增重规律为:若分子组成满足(CO)n.(H2)m的物质,固体增重等于自身质量;若多碳则会多增重,若多氧则会少增重.
解答 解:A.CH3COOCH2CH3可以改写出(CO)2(H2)4C2,组成中碳原子增多,agCH3COOCH2CH3充分燃烧后的气体通过足量过氧化钠,过氧化钠增重大于ag,故A不选;
B.HCOOH可以改写出(CO)O(H2)2,agCH3COOH充分燃烧后的气体通过足量过氧化钠,过氧化钠增重不是ag,故B不选;
C.HOOCCOOH可以改写出(CO)2(H2)O2,组成中氧原子增多,agHOOCCOOH充分燃烧后的气体通过足量过氧化钠,过氧化钠增重小于ag,故C不选;
D.HCHO可以改写出CO.H2,agHCHO充分燃烧后的气体通过足量过氧化钠,过氧化钠增重ag,故D选;
故选D.
点评 本题考查根据反应方程式的计算,为高频考点,关键根据反应方程式寻找质量变化,理解质量变化归纳总结规律,若分子组成满足(CO)n(H2)m的物质,固体增重等于自身质量;若多碳则会增重,若多氧则会少增重,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 合成酚醛树脂的单体是苯酚和甲醇 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | 塑料、合成纤维和合成橡胶都属于合成材料 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
16.下列有关NaHCO3与Na2CO3的说法中不正确的是( )
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 与酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| C. | 热稳定性:Na2CO3>NaHCO3 | |
| D. | 二者间在一定条件下可相互转化 |
3.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用澄清石灰水溶液鉴别苏打、小苏打 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.2 mol NaOH含有0.2NA个NaOH分子 | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.25NA | |
| C. | 常温下,1 mol Cl2与过量NaOH溶液反应,转移电子总数为NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.1NA |
20. 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
(1)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b) kJ/mol(用含a、b的代数式表示).
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的平衡转化率为:75%.
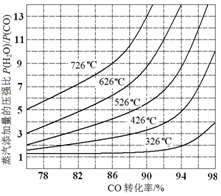
(3)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:(1)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b) kJ/mol(用含a、b的代数式表示).
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
17.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
18.下列有关金属及其化合物的说法不正确的是( )
| A. | 氧化铁俗名铁红,可用作红色涂料 | |
| B. | 氢氧化铝是两性氢氧化物,可用于治疗胃酸过多 | |
| C. | 铁是地壳中含量最多的金属元素 | |
| D. | 保存硫酸亚铁溶液常加铁粉防氧化 |