题目内容
11.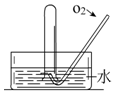 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
分析 NO2气体为红棕色,NO为无色,二氧化氮和水反应生成一氧化氮和硝酸,3NO2+H2O=2HNO3+NO,气体体积减少,一氧化氮常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,二氧化氮和氧气和水能全部转化为硝酸,据此分析解答.
解答 解:NO2气体为红棕色,二氧化氮气体易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO,NO为无色,所以气体颜色由红棕色逐渐变为无色,气体体积减少,试管内的液面会逐渐上升,当反应停止后向试管中缓慢通入氧气,一氧化氮常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;气体颜色又从无色逐渐变为
红棕色,4NO2+O2+2H2O=4HNO3,之后又变为无色,试管内的液面会继续上升,
故答案为:红棕色;无;上升;无;红棕;无;继续上升;3NO2+H2O=2HNO3+NO;2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
点评 本题考查了氮氧化物的性质,及氮氧化物和氧气混合通入水中的有关方程式的书写,关键是分析剩余气体的成分,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
1.事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
| A. | 2Na2O2+2N2O5═4NaNO3+O2↑ | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O4═2NaNO3 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2↑ |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
6.下列化学概念叙述正确的是( )
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
16.下列有关NaHCO3与Na2CO3的说法中不正确的是( )
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 与酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| C. | 热稳定性:Na2CO3>NaHCO3 | |
| D. | 二者间在一定条件下可相互转化 |
3.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用澄清石灰水溶液鉴别苏打、小苏打 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯 |
20. 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
(1)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b) kJ/mol(用含a、b的代数式表示).
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的平衡转化率为:75%.
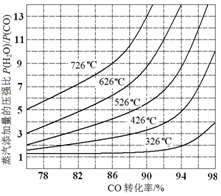
(3)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:(1)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b) kJ/mol(用含a、b的代数式表示).
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
1.0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线所示,下列说法中正确的是( )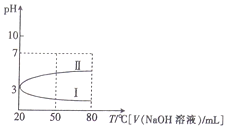

| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
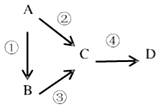 A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.