题目内容
14.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气极易溶于水,能够形成负压差;
B.高锰酸钾能够氧化铁;
C.依据氯化铵加热分解生成氨气与氯化氢解答;
D.酒与水互溶.
解答 解:A.氨气极易溶于水,能够形成负压差而产生喷泉现象,与NH3溶于水显碱性无关,故A错误;
B.高锰酸钾具有强氧化性,能够氧化铁,所以二者应分开存放,故B正确;
C.氯化铵加热分解生成氨气与氯化氢,所以可以用加热法除去NaCl中的NH4Cl,与NH4Cl为强酸弱碱盐无关,故C错误;
D.酒与水互溶,不能用酒精萃取碘水中的碘,故D错误;
故选:B.
点评 本题考查了元素化合物知识,明确物质的性质及用途是解题关键,注意Ⅰ和Ⅱ是否存在因果关系,题目难度不大.

练习册系列答案
相关题目
3.用铜片、银片设计成如图所示的原电池.以下有关该原电池的叙述正确的是( )

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 | |
| B. | 铜导线替换盐桥,原电池仍继续工作 | |
| C. | 开始时,银片上发生的反应是Ag-e-═Ag+ | |
| D. | 电子通过盐桥从乙池流向甲池 |
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | KW/C(OH-)=10-12mol•L-1的溶液中:Na+、K+、SiO32-、Cl- | |
| B. | 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| C. | 由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液中:Na+、CO32-、SO32-、Cl- | |
| D. | 使KSCN显红色的溶液中:NH4+、K+、Cl-、A1O2- |
9.下列四组离子中一定能大量共存的是( )
| A. | K+、H+、Cl-、CO32- | B. | Fe3+、Mg2+、NO3-、SCN- | ||
| C. | NO3- H+、Fe2+、SO42- | D. | Na+、OH-、Cl-、NO3- |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
6.下列化学概念叙述正确的是( )
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
3.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用澄清石灰水溶液鉴别苏打、小苏打 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯 |
4.化学与生活、生产、环境密切相关,下列有关说法错误的是( )
| A. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| B. | 氢能是一种新型能源,具有热值高、资源丰富、无毒、无污染的优点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 合成氨工业中,使用催化剂不能提高H2和N2的转化率 |
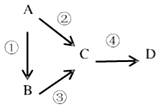 A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.