题目内容
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.2 mol/L与0.1mol/L 醋酸溶液中c(H+)之比>2:1 |
| B、向0.1 mol/L 醋酸钠溶液中加入适量盐酸,得到的中性溶液:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH) |
| C、pH=4的H2S溶液与pH=10 的NaOH溶液等体积混合:c(Na+)>2c(S2- )+c(HS-) |
| D、已知0.1 mol/L的二元酸H2A溶液pH=4.0,则在NaHA溶液中一定有:2c(OH-)+c(A2-)=c(H2A)+2c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.醋酸为弱酸,醋酸的浓度越大,其电离程度越小;
B.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)+c(Cl-);根据物料守恒可得:c(Na+)=c(CH3COO-)+c(CH3COOH),则c(Cl-)=c(CH3COOH);
C.氢硫酸为弱酸,两溶液混合后溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒进行判断;
D.0.1 mol/L的二元酸H2A溶液pH=4.0,说明该酸为二元弱酸,根据电荷守恒和物料守恒进行判断.
B.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)+c(Cl-);根据物料守恒可得:c(Na+)=c(CH3COO-)+c(CH3COOH),则c(Cl-)=c(CH3COOH);
C.氢硫酸为弱酸,两溶液混合后溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒进行判断;
D.0.1 mol/L的二元酸H2A溶液pH=4.0,说明该酸为二元弱酸,根据电荷守恒和物料守恒进行判断.
解答:
解:A.0.2mol/L和0.1mol/L的两醋酸溶液中,前者醋酸的电离程度小于后者,则H+离子浓度之比为小于2:1,故A错误;
B.向0.1 mol/L 醋酸钠溶液中加入适量盐酸,由于醋酸根离子的水解程度较小,则加入的盐酸的量较小;混合液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒可得:c(Na+)=c(CH3COO-)+c(CH3COOH),则c(Cl-)=c(CH3COOH),则得到的中性溶液:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH),故B正确;
C.氢硫酸为弱酸,两溶液混合后溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<2c(S2- )+c(HS-),故C错误;
D.0.1 mol/L的二元酸H2A溶液pH=4.0,则该酸为二元弱酸,根据NaHA溶液中电荷守恒可知:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),根据物料守恒可知:c(Na+)=c(H2A)+c(HA-)+c(A2-),二者结合可得:c(OH-)+c(A2-)=c(H2A)+c(H+),故D错误;
故选B.
B.向0.1 mol/L 醋酸钠溶液中加入适量盐酸,由于醋酸根离子的水解程度较小,则加入的盐酸的量较小;混合液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒可得:c(Na+)=c(CH3COO-)+c(CH3COOH),则c(Cl-)=c(CH3COOH),则得到的中性溶液:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH),故B正确;
C.氢硫酸为弱酸,两溶液混合后溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<2c(S2- )+c(HS-),故C错误;
D.0.1 mol/L的二元酸H2A溶液pH=4.0,则该酸为二元弱酸,根据NaHA溶液中电荷守恒可知:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),根据物料守恒可知:c(Na+)=c(H2A)+c(HA-)+c(A2-),二者结合可得:c(OH-)+c(A2-)=c(H2A)+c(H+),故D错误;
故选B.
点评:本题考查了离子浓度大小比较、盐的水解原理及其应用,题目难度中等,注意掌握比较溶液中离子浓度大小的方法,明确电荷守恒、物料守恒、盐的水解在比较离子浓度中的应用方法.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
铁、钴、镍的原子序数分别为26、27、28,它们的性质相似,被称为铁系元素.已知反应Fe2O3+6HCl=2FeCl3+3H2O,Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,则下列物质的氧化能力由强到弱的顺序是( )
| A、Fe2O3>Co2O3>Cl2 |
| B、Cl2>Fe2O3>Co2O3 |
| C、Cl2>Co2O3>Fe2O3 |
| D、Co2O3>Cl2>Fe2O3 |
某溶液中投入铝片可放出氢气,则该溶液可能存在的离子组是( )
| A、Fe2+、Cl-、NO3-、Na+、Al3+ |
| B、Mg2+、Ba2+、SO42-、Cl-、Al3+ |
| C、H+、Cl-、SO42-、K+、Al3+ |
| D、Na+、K+、SO42-、OH-、Al3+ |
2012年3月29日,武汉大学张俐娜教授因对“纤维素低温溶解”的开创性研究,获得2011年度安塞姆佩恩奖(国际上纤维素与可再生资源材料领域的最高奖).制备乙酸乙酯的绿色合成路线之一为:
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、N的结构简式为CH3COOH |
| C、M可以发生水解反应 |
| D、乙酸乙酯和N均能和NaOH溶液发生反应 |
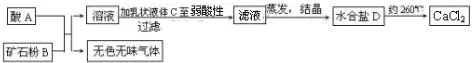
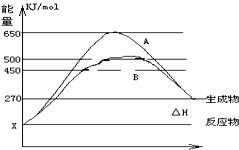 (1)已知:Fe(s)+
(1)已知:Fe(s)+