题目内容
某溶液中投入铝片可放出氢气,则该溶液可能存在的离子组是( )
| A、Fe2+、Cl-、NO3-、Na+、Al3+ |
| B、Mg2+、Ba2+、SO42-、Cl-、Al3+ |
| C、H+、Cl-、SO42-、K+、Al3+ |
| D、Na+、K+、SO42-、OH-、Al3+ |
考点:离子共存问题
专题:
分析:某溶液投入铝片放出大量氢气,该溶液为酸或强碱溶液,再结合离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,则离子能大量共存.
解答:
解:某溶液投入铝片放出大量氢气,该溶液为酸或强碱溶液,
A.酸性条件下,NO3-具有强氧化性,可以氧化Fe2+,碱溶液中Fe2+、OH-结合生成沉淀,则一定不能共存,故A错误;
B.Ba2+、SO42-结合为BaSO4沉淀,则一定不能共存,故B错误;
C.酸性条件下,各离子不反应,可以大量共存,故C正确;
D.OH-、Al3+结合为氢氧化铝沉淀,不能大量共存,故D错误;
故选C.
A.酸性条件下,NO3-具有强氧化性,可以氧化Fe2+,碱溶液中Fe2+、OH-结合生成沉淀,则一定不能共存,故A错误;
B.Ba2+、SO42-结合为BaSO4沉淀,则一定不能共存,故B错误;
C.酸性条件下,各离子不反应,可以大量共存,故C正确;
D.OH-、Al3+结合为氢氧化铝沉淀,不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存,掌握元素化合物性质是关键,注意投入铝片放出大量氢气的溶液,该溶液为酸或强碱溶液.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
等质量的下列有机物完全燃烧时,耗氧量最大的是( )
| A、甲烷 | B、乙烯 | C、乙烷 | D、苯 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.2 mol/L与0.1mol/L 醋酸溶液中c(H+)之比>2:1 |
| B、向0.1 mol/L 醋酸钠溶液中加入适量盐酸,得到的中性溶液:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH) |
| C、pH=4的H2S溶液与pH=10 的NaOH溶液等体积混合:c(Na+)>2c(S2- )+c(HS-) |
| D、已知0.1 mol/L的二元酸H2A溶液pH=4.0,则在NaHA溶液中一定有:2c(OH-)+c(A2-)=c(H2A)+2c(H+) |
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 产物 | 产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 |
| A、反应①中可能有一种或两种元素被氧化 |
| B、反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- |
| C、反应②中KClO3被氧化,HCl被还原 |
| D、若反应②的另一种产物是KCl,则反应过程中1molKClO3得到6mole- |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ |
| B、使酚酞试液变红的溶液中:S2-、SO42-、SO32-、Na+ |
| C、pH=0的溶液中:Na+、K+、Fe2+、NO3- |
| D、pH=7的溶液中:Al3+、Cl-、SO42-、CO32- |
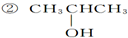
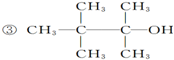
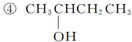
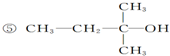
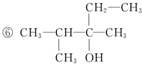
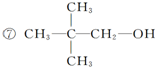
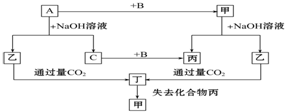 已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:
已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答: