题目内容
13.氯气和氨气在常温下混合即可发生反应.某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置: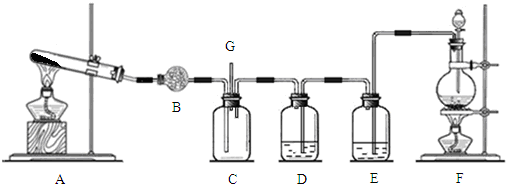
请回答:
(1)装置F中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置D中盛放的试剂是浓硫酸,其作用是干燥氯气;
(3)A装置还可用于制取气体O2(只填一种);
(4)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是4.48 L,
(5)装置C中有白烟产生,试写出反应的化学方程式NH3+HCl=NH4Cl;
(6)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有NaOH溶液的洗气瓶.
分析 (1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,先用饱和食盐水除去HCl,再用浓硫酸除去水蒸气;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,用该装置还可以制备氧气;
(4)计算氯化铵的物质的量,根据N原子守恒计算氨气物质的量,再根据V=nVm计算氨气体积;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵;
(6)氯气能与氢氧化钠溶液反应,用氢氧化钠溶液吸收过量的氯气,防止污染空气.
解答 解:(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,E中盛放饱和食盐水,除去HCl,D中盛放浓硫酸,除去水蒸气,干燥氯气,
故答案为:浓硫酸;干燥氯气;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,还可以加热高锰酸钾或加热氯酸钾与二氧化锰混合物制备氧气,
故答案为:O2;
(4)氯化铵的物质的量为$\frac{10.7g}{53.5g/mol}$=0.2mol,根据N原子守恒,可知生成氨气物质的量为0.2mol,标况下制得氨气体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵,反应方程式为:NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
(6)氯气能与氢氧化钠溶液发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,可以用盛有氢氧化钠溶液的洗气瓶吸收,防止污染空气,
故答案为:NaOH溶液.
点评 本题考查氯气、氨气的制备和性质实验,题目难度不大,注意把握实验的原理和物质的化学性质,有利于基础知识的巩固.

 名校课堂系列答案
名校课堂系列答案| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
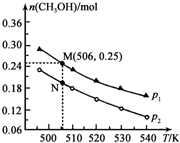
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
| A. | 加热胆矾失去结晶水的过程称风化 | |
| B. | 在饱和溶液中,溶质溶解的速率等于结晶速率 | |
| C. | 原电池是把电能转化为化学能的装置 | |
| D. | 电能是二次能源 |
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.