题目内容
19.下列说法正确的是( )| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
分析 A.碳酸氢钠溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
B.在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,碳酸钠和碳酸氢钠物质的量相同,碳酸钠溶液中阳离子数多;
C.在Na2CO3和NaHCO3两溶液中,碳酸钠溶液中碳酸根离子分步水解,碳酸氢钠溶液中碳酸氢根离子水解和电离,离子种类相同;
D.碳酸氢钠溶液中碳酸氢根离子水解大于电离,溶液显碱性;
解答 解:A.在NaHCO3溶液中一定有电荷守恒,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故A正确;
B.在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,碳酸钠和碳酸氢钠物质的量相同,碳酸氢根离子是弱酸阴离子,所以碳酸钠溶液中阳离子数多,故B错误;
C.碳酸钠溶液中碳酸根离子分步水解,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,碳酸氢根离子水解,HCO3-+H2O?H2CO3+OH-,电离HCO3-?H++CO32-,离子种类相同,故C错误;
D.碳酸氢钠溶液中碳酸氢根离子水解大于电离,溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(OH-)>c(H+)>c(CO32-),故D错误;
故选A.
点评 本题考查了盐类水解原理,电解质溶液中电离平衡、水解平衡的相对大小程度、电解质溶液中电荷守恒,注意离子数的大小比较,题目难度中等.

练习册系列答案
相关题目
9.人体中因缺少或过多会患甲状腺疾病的元素是( )
| A. | Na | B. | Cl | C. | Fe | D. | I |
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2SO4含有的原子数为7NA | |
| B. | 16g氧气和16g臭氧含有的氧原子数均为NA | |
| C. | 常温常压下,14gN2含有电子数为14NA | |
| D. | 28gCO与22.4LCO2所含的碳原子数相等 |
14.已知反应Cu2S+2Cu2O
6Cu+SO2↑,还原剂为Cu2S,当有64gCu生成时,转移1mol电子.
| ||
11.试管中装有足量的煤油和水的混合物,静置后投入一小块碱金属.可观察到金属在煤油和水的界面附近上下往复运动,下列说法不正确的是( )
| A. | 此碱金属可能是钾或钠 | |
| B. | 反应过程中煤油不会燃烧 | |
| C. | 碱金属上下运动是由于与水反应产生了气体 | |
| D. | 若是金属钾则上下运动的幅度比钠小 |

 ,B
,B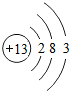 ,二者离子半径:Na+>Al3+(填离子符号).
,二者离子半径:Na+>Al3+(填离子符号). .
.