题目内容
4. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
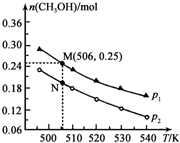
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)根据原子利用率表示目标产物的质量与生成物总质量之比来比较;根据平衡常数越大越有利于反应的进行;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,结合图可知,P1>P2,根据压强对反应速率的影响答题;
③在可逆反应中,增加一种反应物浓度可以提高另一反应物的转化率;
④图中M点时,容器体积为10L,结合M点的坐标可知,M点的CH3OH的物质的量为0.25mol,
根据反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L) 0.1 0.275 0 0
转化(mol/L)0.025 0.075 0.025 0.025
平衡(mol/L) 0.075 0.2 0.025 0.025
根据K=$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{{c}^{3}({H}_{2})c(C{O}_{2})}$计算;
(3)设转化的二氧化碳的物质的量为x,
根据反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
起始 a b 0 0
转化 x 3x x x
平衡 a-x b-3x x x
则CO2的体积分数为$\frac{a-x}{a-x+b-3x+x+x}$=$\frac{a-x}{a+b-2x}$,据此讨论.
解答 解(1)CO(g)+2H2(g)?CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,)△H1═1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,热化学方程式CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1,
故答案为:CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)因原子利用率表示目标产物的质量与生成物总质量之比,反应I的原子利用率为$\frac{30}{32}$×100%=93.7%,反应II的原子利用率为$\frac{30}{48}$×100%=62.5%;平衡常数越大越有利于反应的进行,
故答案为:Ⅰ,Ⅱ;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,△H<0,
故答案为:<;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,压强增大,反应速率也增大,所以v(N)<v(M),
故答案为:<;
③在可逆反应中,增加一种反应物浓度可以提高另一反应物的转化率,所以为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢气物质的量比二氧化碳物质的量的值,
故答案为:增大氢碳比;
④图中M点时,容器体积为10L,结合M点的坐标可知,M点的CH3OH的物质的量为0.25mol,
根据反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L) 0.1 0.275 0 0
转化(mol/L)0.025 0.075 0.025 0.025
平衡(mol/L) 0.075 0.2 0.025 0.025
K=$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{{c}^{3}({H}_{2})c(C{O}_{2})}$=$\frac{0.025×0.025}{0.{2}^{3}×0.075}$=1.04,
故答案为:1.04;
(4)设转化的二氧化碳的物质的量为x,
根据反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
起始 a b 0 0
转化 x 3x x x
平衡 a-x b-3x x x
则CO2的体积分数为$\frac{a-x}{a-x+b-3x+x+x}$=$\frac{a-x}{a+b-2x}$,要使$\frac{a-x}{a+b-2x}$为恒定的值,则a=b,
故答案为:a=b.
点评 本题属于拼合型题目,涉及化学键键能计算反应焓变、化学平衡常数、化学平衡影响因素等知识,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | 此碱金属可能是钾或钠 | |
| B. | 反应过程中煤油不会燃烧 | |
| C. | 碱金属上下运动是由于与水反应产生了气体 | |
| D. | 若是金属钾则上下运动的幅度比钠小 |
| A. | 元素原子得电子能力:W<X<Y<Z | B. | 原子最外层电子数::W<X<Y<Z | ||
| C. | 原子半径:W>X>Y>Z | D. | 元素的最高化合价:W<X<Y<Z |
| A. | 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值都是相同的 | |
| B. | 其它条件不变时,升高温度,反应速率加快 | |
| C. | 其它条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |

 .
.
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题