题目内容
1. 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
分析 形成原电池反应时,活泼金属为负极,电子由负极经外电路流向正极,由电子流向可知X、Z的活泼性比Cu强,Y的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为Z>X>Cu>Y,以此解答.
解答 解:形成原电池反应时,活泼金属为负极,电子由负极经外电路流向正极,由电子流向可知X、Z的活泼性比Cu强,Y的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为Z>X>Cu>Y,
A.Z比Y活泼,组成原电池反应时,Z被氧化,则Z金属可作为牺牲阳极保护法的阳极,保护Y金属,故A正确;
B.Y的活泼性比铜弱,则不能与硫酸反应置换出氢气,故B正确;
C.由以上分析可知三种金属的活泼性顺序为:Z>X>Y,故C错误;
D、活泼性最强的为Z,最弱的为Y,则Z和Y能构成电压最大的原电池,故D正确.
故选C.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,为高考高频考点,注意根据题给信息解答该题,仔细审题,加强审题能力的培养,把握金属的活泼性强弱,为解答该题的关键,难度中等.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2SO4含有的原子数为7NA | |
| B. | 16g氧气和16g臭氧含有的氧原子数均为NA | |
| C. | 常温常压下,14gN2含有电子数为14NA | |
| D. | 28gCO与22.4LCO2所含的碳原子数相等 |
9.对于反应3A+B═2C,下列说法正确的是( )
| A. | 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值都是相同的 | |
| B. | 其它条件不变时,升高温度,反应速率加快 | |
| C. | 其它条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
6.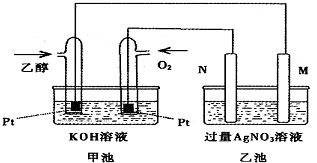 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )| A. | M电极的材料是石墨 | |
| B. | 若乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气为224mL | |
| C. | 在此过程中,甲池中OH-向通乙醇的一极移动 | |
| D. | 在此过程中,乙池溶液中电子从M电极向N电极移动 |
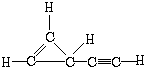 .
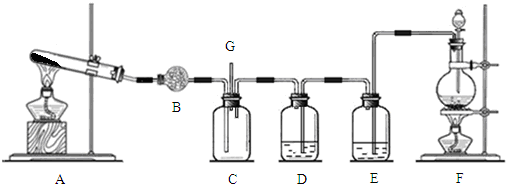
.
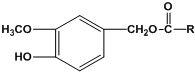 (R为烃基)
(R为烃基)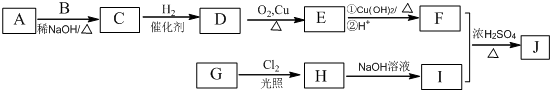
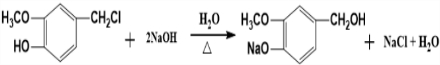 .
. .
.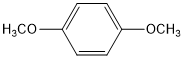 (写结构简式).
(写结构简式).