题目内容
8.氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+SO2(g)?N2(g)+S(l)+4H2O(g)△H<0.下列有关说法正确的是( )| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
分析 A.当v(H2)=v(H2O)时,可能都是正反应,无法判断是否达到平衡;
B.升高温度后,正逆反应速率都增大;
C.催化剂不影响化学平衡,所以不会影响NO的转化率;
D.根据平衡常数的概念及化学反应方程式判断.
解答 解:A.v(H2)=v(H2O),没有告诉正逆反应速率,无法判断是否达到平衡状态,故A错误;
B.温度升高后,正反应速率和逆反应速率都增大,由于逆反应速率增大的幅度大于正反应,所以平衡向着逆向移动,故B错误;
C.使用高效催化剂可以增大反应速率,但是不影响化学平衡,无法提高NO的平衡转化率,故C错误;
D.反应4H2(g)+2NO(g)+SO2(g)?N2(g)+S(l)+4H2O(g)△H<0的化学常数表达式为为:K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$,故D正确;
故选D.
点评 本题考查了化学平衡及其影响,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学平衡状态的判断方法、化学平衡常数的概念及表达式,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.已知反应Cu2S+2Cu2O
6Cu+SO2↑,还原剂为Cu2S,当有64gCu生成时,转移1mol电子.
| ||
15.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
| A. | 元素原子得电子能力:W<X<Y<Z | B. | 原子最外层电子数::W<X<Y<Z | ||
| C. | 原子半径:W>X>Y>Z | D. | 元素的最高化合价:W<X<Y<Z |
17.某原电池工作时总的反应为Zn+Cu2+═Zn2++Cu,该原电池的组成可能是( )
| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
18.氯气和漂白粉是现代工业和生活常用的消毒、杀菌剂,实验室拟用下列装置制备干燥纯净的氯气.(提示:2NaCl+H2SO4(浓)═Na2SO4+2HCl↑)
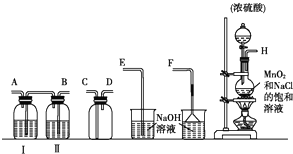
(1)请从下列试剂中选择:Ⅰ中所盛试剂为C,Ⅱ中所盛试剂为B. (选填字母)
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按气体从左向右流动的方向将仪器进行连接:H→B→A→C→D→F;
你选择的最后一个装置的理由是防止倒吸,连接好实验装置后的下一步操作是检验装置气密性.
(3)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2 +2Ca(OH)2 =CaCl2 +Ca(ClO)2 +2H2O,若标况下,33.6L Cl2参加反应,则转移电子1.5mol.
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2,请设计实验,探究该样品中可能存在的其他固体物质.
①提出合理假设.
假设1:该漂白粉未变质,只含Ca(ClO)2;
假设2:该漂白粉全部变质,只含CaCO3;
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)2.
②设计实验方案,进行实验,并写出实验步骤、预期现象与结论.
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1mol/L盐酸、新制澄清石灰水.(提示:不必检验Ca2+和Cl-)

(1)请从下列试剂中选择:Ⅰ中所盛试剂为C,Ⅱ中所盛试剂为B. (选填字母)
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按气体从左向右流动的方向将仪器进行连接:H→B→A→C→D→F;
你选择的最后一个装置的理由是防止倒吸,连接好实验装置后的下一步操作是检验装置气密性.
(3)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2 +2Ca(OH)2 =CaCl2 +Ca(ClO)2 +2H2O,若标况下,33.6L Cl2参加反应,则转移电子1.5mol.
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2,请设计实验,探究该样品中可能存在的其他固体物质.
①提出合理假设.
假设1:该漂白粉未变质,只含Ca(ClO)2;
假设2:该漂白粉全部变质,只含CaCO3;
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)2.
②设计实验方案,进行实验,并写出实验步骤、预期现象与结论.
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1mol/L盐酸、新制澄清石灰水.(提示:不必检验Ca2+和Cl-)
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入澄清石灰水中. | (1)若澄清石灰水未见浑浊,则假设1成立; (2)若澄清石灰水变浑浊,则假设2或3成立. |
| ② | 向步骤①反应后的试管中滴入1~2滴品红溶液,振荡(或另外取样操作) | 结合实验①中的(2), (1)若品红褪色,则假设3成立; (2)若品红不褪色,则假设2成立. |
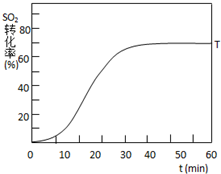 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.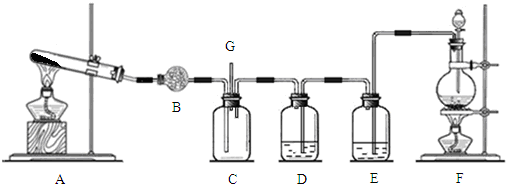
 在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:
在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答: