题目内容
2.在一定条件下,Na2CO3溶液中存在如下反应:CO${\;}_{3}^{2-}$+H2O═HCO${\;}_{3}^{-}$+OH-下列说法中正确的是( )| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
分析 碳酸钠溶液中,碳酸根离子存在水解平衡:CO32-+H2O?HCO3-+OH-,
A.$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$为碳酸根离子的水解平衡常数,温度不变,则该比值不变;
B.加入碳酸钠过量,碳酸根离子的浓度增大幅度大于碳酸根离子的水解程度,则溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$的比值减小;
C.盐的水解为吸热反应,升高温度后水解程度增大,水解平衡向着正向移动,导致平衡常数增大;
D.通入二氧化碳后,碳酸根离子浓度减小,溶液的pH减小.
解答 解:A.溶液中加水,由于温度不变,则碳酸根离子的水解平衡常数$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不会发生变化,故A错误;
B.加入Na2CO3固体,溶液中碳酸根离子浓度增大,由于水解程度较小,则溶液中碳酸根离子的浓度增大程度大于碳酸氢根离子,所以$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$的比值会减小,故B正确;
C.升高温度后,碳酸根离子的水解平衡向着正向移动,则该水解平衡常数会增大,故C错误;
D.碳酸钠溶液中通入二氧化碳,反应生成碳酸氢钠,碳酸根离子浓度减小,溶液的pH减小,故D错误;
故选B.
点评 本题考查了盐的水解原理及其影响,题目难度中等,明确影响盐的水解的因素为解答关键,注意掌握电离平衡常数的概念及其影响,试题有利于培养学生的分析、理解能力.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
17.某原电池工作时总的反应为Zn+Cu2+═Zn2++Cu,该原电池的组成可能是( )
| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
 .
.
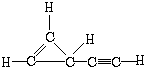
 (R为烃基)
(R为烃基)
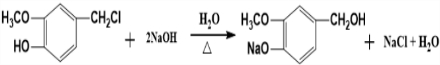 .
. .
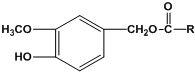
.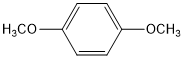 (写结构简式).
(写结构简式).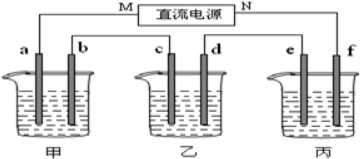
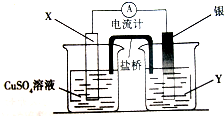
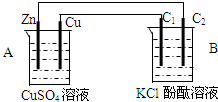 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题