题目内容
11.用双线桥法分析下列氧化还原反应中电子转移的方向及化合价的变化,并指出氧化剂和还原剂(1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl 氧化剂Cl2还原剂H2
(2)Zn+H2SO4=ZnSO4+H2↑ 氧化剂H2SO4还原剂Zn
(3)2KMnO4 $\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑ 氧化剂KMnO4还原剂KMnO4.
分析 (1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反应中氢元素化合价升高失电子做还原剂,氯元素化合价降低得到电子做氧化剂,电子转移总数2e-;
(2)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂;
(3)2KMnO4═K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,转移电子是4mol,氧化还原反应中元素化合价升高的物质失电子最还原剂,元素化合价降低得到电子做氧化剂.
解答 解:(1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反应中氢元素化合价0价变化为+1价,氢气做还原剂,氯元素化合价0价变化为-1价,氯气做氧化剂,电子转移总数2e-,电子转移的方向和数目为: ,故答案为:
,故答案为: ;Cl2;H2;
;Cl2;H2;
(2)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
该反应中转移的电子数为2e-,电子转移的方向和数目为 ,故答案为:
,故答案为: ;H2SO4;Zn;
;H2SO4;Zn;
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ;KMnO4是氧化剂,KMnO4是还原剂,
;KMnO4是氧化剂,KMnO4是还原剂,
故答案为: ;KMnO4;KMnO4.
;KMnO4;KMnO4.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: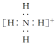 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
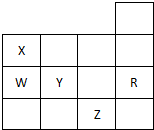
| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:CH3CH2OH$\frac{{H}_{2}S{O}_{4}(浓)}{170℃}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中仪器a和b的名称分别为恒压分液漏斗、三颈烧瓶;
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)判断该制备反应已经结束的最简单方法是观察D中颜色是否完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.亚硫酸氢钠 c.碘化钠溶液 d.乙醇
(5)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2一二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.