题目内容
17.下列有关说法不正确的是( )| A. | C3H8中碳原子都采用的是sp3杂化 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO | |
| D. | CO的一种等电子体为NO+,它的电子式为+ |
分析 A.根据价电子对互斥理论确定原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
B.结构对称,正负电荷的中心重合,则为非极性分子;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,图中NO+的电子式书写错误.
解答 解:A.C3H8分子中每个C原子含有4个σ键,所以每个C原子价层电子对个数是4,则C原子采用sp3杂化,故A正确;
B.O2、N2为只含有非极性键,属于非极性分子,CO2 为直线形分子,结构对称为非极性分子,故B正确;
C.非金属性:S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2SO4>H3PO4>H2CO3,又H2CO3酸性大于HClO,则有酸性:H2SO4>H3PO4>H2CO3>HClO,故C错误;
D.根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,如果是阳离子离子,原子序数之和减去所带电荷数值等于电子数,所以NO+为CO的一种等电子体,NO+它的电子式为 ,故D错误;
,故D错误;
故选CD.
点评 本题较为综合,考查了元素的杂化、非极性分子的判断、等电子体、元素周期律的应用,题目难度中等,注意把握杂化类型的判断方法.注意根据分子是否对称确定分子极性.

练习册系列答案
相关题目
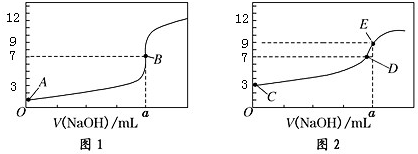
8.常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HCl 溶液和 20.00mL0.1000mol/L CH3COOH 溶液,得到2条滴定曲线,如图所示:
以下说法正确的是( )

以下说法正确的是( )
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
5.草酸二酯(CPPO)结构简式如图所示,下列有关草酸二酯的说法错误的是( )

| A. | 草酸二酯属于芳香族化合物 | |
| B. | 1mol草酸二酯最多可与4molNaOH反应 | |
| C. | 草酸二酯难溶于水 | |
| D. | 草酸二酯的分子式为C26H24O8Cl6 |
9.下列实验能证明一元酸HA是弱电解质的是( )
| A. | 将25℃1mL pH=3的HA溶液加水稀释至100mL,稀释后溶液的PH=4 | |
| B. | HA溶液与NaHCO3溶液反应放出CO2 | |
| C. | 25℃时,NaA溶液的pH大于7 | |
| D. | 往HA溶液中滴入甲基橙,溶液呈橙色,不呈红色 |
6.下列各组物质两种含氧酸中,前者比后者酸性弱的是( )
| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | HClO4和H2SiO3 |
7.某元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,下列正确的是( )
| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第二周期ⅤA族 | ||
| C. | 氢化物稳定性比PH3弱 | D. | 常见化合价只有-3、+2、+3、+5价 |
