��Ŀ����
4��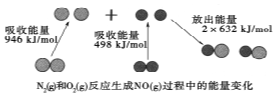 ��ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ģ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵������ȷ���ǣ�������
��ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ģ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵������ȷ���ǣ�������| A�� | 1mol N2��g����1mol O2��g����Ӧ�ų�������Ϊ180kJ | |
| B�� | NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ | |
| C�� | ��1L�������з�����Ӧ��10min�� N2������1mol�����10min�ڵ�ƽ����Ӧ����Ϊv��NO��=0.1mol/��L•min�� | |
| D�� | 1mol N2��g����1mol O2��g�������������2mol NO��g����������� |
���� A�����ݷ�Ӧ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų������������жϣ�
B��NO��������������Һ��Ӧ��
C������v=$\frac{\frac{��n}{V}}{��t}$������õ�����ʾ�ķ�Ӧ���ʣ�Ȼ����ݷ�Ӧ�����뻯ѧ�����������ȼ���v��NO����
D������A������ʱ��жϷ�Ӧ�����仯��
��� �⣺A���ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų���������N2+O2=2NO��H=946kJ/mol+498kJ/mol-2��632kJ/mol=+180kJ/mol���ʸ÷�Ӧ�����ȷ�Ӧ����A����
B��һ������������������Һ����Ӧ���Dz������������B����
C����1L�������з�����Ӧ��10min��N2������1mol�����10min�ڵ�ƽ����Ӧ���ʣ�v��N2��=$\frac{\frac{1mol}{1L}}{10min}$=0.1mol/��L•min�������ݷ�ӦN2+O2=2NO��֪��v��NO��=2vv��N2��=0.2mol/��L•min������C����
D������A�����֪��Ӧ�����ȷ�Ӧ����1 mol N2��g����1 mol O2��g�����е�������С��2 mol NO��g�����е�����������D��ȷ��
��ѡD��
���� ���⿼�鷴Ӧ�����ʱ���ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų�������Ϊ���ؼ���ע�����ջ�ѧ��Ӧ�������仯 �Ĺ�ϵ������������ѧ���ķ�����������ѧ����������

| A�� | 8�� | B�� | 10�� | C�� | 16�� | D�� | 20�� |
| A�� | �Ҵ�ȼ�� | B�� | ��ϩʹ������Ȼ�̼��Һ��ɫ | ||
| C�� | �����������ϣ����� | D�� | ���Ҵ���������ŨH2SO4��ϼ��� |
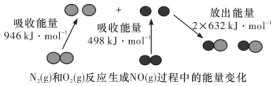 ��ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ģ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵������ȷ���ǣ�������
��ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ģ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵������ȷ���ǣ�������| A�� | 1 mol N2��g����1 mol O2��g����Ӧ�ų�������Ϊ180 kJ | |
| B�� | 1 mol N2��g����1 mol O2��g�������������2 mol NO��g����������� | |
| C�� | ��1 L�������з�����Ӧ��10 min�� N2 ������1 mol�����10 min�ڵ�ƽ����Ӧ����Ϊv��NO��=0.1 mol/��L•min�� | |
| D�� | NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ |
| A�� | H2O | B�� | CaCl2 | C�� | KOH | D�� | Cl2 |
| ��ѧʽ | CO��g�� | H2��g�� | CH3OH��l�� | CH4��g�� |
| ��H/��kJ/mol�� | -283.0 | -285.8 | -726.5 | -890.3 |
��1��д����������CH3OH��l����ȫȼ�յ��Ȼ�ѧ����ʽ��CH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��l����H=-726.5KJ•mol-1��
��2�����ݸ�˹����������з�Ӧ���Ȼ�ѧ����ʽ��CO��g��+2H2��g��?CH3OH��l������H=-128.1KJ•mol-1��
��3����ҵ������ˮú���ϳɼ״�����Ҫ��Ӧ�ɱ�ʾΪ0.5CO��g��+H2��g��?0.5CH3OH��g����H=-45.4kJ•mol-1�����ݻ�Ϊ1L���ܱ������м���0.10mol H2��0.05mol CO����һ���¶��·���������Ӧ��10min��Ӧ�ﵽƽ��״̬����÷ų�����3.632kJ��
����ͬ�¶������£�������Ӧ�Ļ�ѧƽ�ⳣ��K=100��
���������ݻ����䣬���д�ʩ������CH3OH���ʵ���BD����д��ţ���
A�������¶�
B����CH3OH��g������ϵ�з���
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���0.10mol H2��0.05molCO
E���������
�۷�Ӧ�ﵽƽ����������������䣬��ֻ�������������Сһ�룬ƽ�⽫����ѡ��������������ƶ�����ѧƽ�ⳣ��K���䣨ѡ�������С�����䡱����
���¶ȡ��ݻ���ͬ�ļס��������ܱ������������м���1molCO��2mol H2�����м���1mol CH3OH��g������Ӧ�ﵽƽ��ʱ�ų�������ΪQ1kJ�������յ�����ΪQ2 kJ����Ӧ���ת���ʷֱ�Ϊa1��a2����Q1+Q2=90.8��a1+a2=1��