题目内容
7.已知25℃、101kpa时,一些物质的燃烧热为:| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ•mol-1.
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)?CH3OH(l);△H=-128.1KJ•mol-1.
(3)工业上利用水煤气合成甲醇的主要反应可表示为0.5CO(g)+H2(g)?0.5CH3OH(g)△H=-45.4kJ•mol-1.向容积为1L的密闭容器中加入0.10mol H2和0.05mol CO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ.
①相同温度条件下,上述反应的化学平衡常数K=100.
②若容器容积不变,下列措施可增加CH3OH产率的是BD(填写序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.10mol H2和0.05molCO
E.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将正向(选填“逆向”“正向”或“不”)移动,化学平衡常数K不变(选填“增大”“减小”或“不变”).
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2mol H2,乙中加入1mol CH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2 kJ,反应物的转化率分别为a1、a2.则Q1+Q2=90.8;a1+a2=1.
分析 (1)根据燃烧热的定义:在25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.S转化为SO2,C转化为二氧化碳,H转化为液态水.故可以得出CH3OH完全燃烧的热化学方程式;
(2)分别写出CO、H2、CH3OH热化学方程式后,根据盖斯定律就可得出要求的热化学方程式及反应热;
(3)①利用三段式来解题;
②据化学平衡移动原理,增加甲醇产率,即使化学平衡正向移动即可;
③根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
④CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同;令平衡时CO的物质的量为nmol,CO(g)+2H2(g)?CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2.
解答 解:(1)燃烧热的概念:在25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.此时S应转化为SO2,C应转化为二氧化碳,H应转化为液态水,
故△H═-726.5 kJ•mol-1指的是1molCH3OH(l)完全燃烧生成二氧化碳和液态水时的反应热,故CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ•mol-1
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ•mol-1;
(2)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ•mol-1 ③
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-128.1KJ•mol-1
故答案为:-128.1KJ•mol-1;
(3)①根据热化学方程式:H2(g)+$\frac{1}{2}$CO(g)?$\frac{1}{2}$CH3OH(g)△H=-45kJ•mol-1 可知,当反应掉1mol氢气时,放热45KJ,故当放出热量3.632kJ时,反应掉的氢气为0.08mol,根据三段式:
H2(g)+$\frac{1}{2}$CO(g)?$\frac{1}{2}$CH3OH(g)
初始C(mol/L):0.10mol/L 0.05mol/L 0
△C(mol/L):0.08mol/L 0.04mol/L 0.04mol/L
平衡C(mol/L):0.02mol/L 0.01mol/L 0.04mol/L
根据化学平衡常数K=$\frac{\sqrt{c(C{H}_{3}OH)}}{c({H}_{2})\sqrt{c(CO)}}$=$\frac{\sqrt{0.04mol/L}}{0.02mol/L×\sqrt{0.01mol/L}}$=100,故答案为:100;
②A.该反应是放热的,升高温度,平衡逆向进行,会减小甲醇产率,故A错误;
B.将CH3OH(g)从体系中分离,会促使平衡正向移动,提高甲醇的产率,故B正确;
C.充入He,使体系总压强增大,体积不变,各组分浓度不变,所以平衡不会移动,不会改变甲醇产率,故C错误;
D.再充入0.05mol CO和0.1molH2,增大压强,平衡右移,有利提高甲醇的产率,故D正确;
E.加入催化剂,改变反应速率,但不改变平衡的移动,不改变甲醇产率,故E错误;故选BD,
故答案为:BD;
③该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为;正向;不变;
④甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,故(1-α1)=α2,整理得α1+α2=1;
令平衡时CO的物质的量为nmol,CO(g)+2H2(g)?CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2,故1mol CH3OH,则放出(Q1+Q2)kJ=45.4kJ×2=90.8kJ,
故答案为:90.8;1.
点评 本题考查了燃烧热的概念与盖斯定律、热化学方程式的书写、化学平衡常数的计算及应用、及等效平衡的应用,综合考查,难点较大,重视基础是解题关键.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案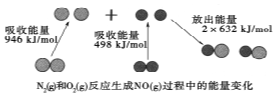 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 在1L的容器中发生反应,10min内 N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L•min) | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
| A. | 甲酸(HCOOH)与正丁醇 | B. | 乙酸与甲醇(CH3OH) | ||
| C. | 乙醇与CH3CH2COOH | D. | CH3CH2COOH与甲醇(CH3OH) |
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 | 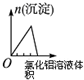 |  | 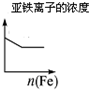 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
