题目内容
16.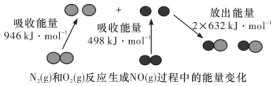 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
分析 A.依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B.依据A计算的焓变判断反应能量变化;
C.根据v=$\frac{\frac{△n}{V}}{△t}$计算出用氮气表示的反应速率,然后根据反应速率与化学计量数成正比计算v(NO);
D.NO不与氢氧化钠溶液反应.
解答 解:A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,故该反应是吸热反应,故A错误;
B.依据A计算可知反应是吸热反应,故1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C.在1L的容器中发生反应,10min内N2减少了1mol,因此10min内的平均反应速率:v(N2)=$\frac{\frac{1mol}{1L}}{10min}$=0.1mol/(L•min),根据反应N2+O2=2NO可知,v(NO)=2vv(N2)=0.2mol/(L•min),故C错误;
D.一氧化氮与氢氧化钠溶液不反应,NO是不成盐氧化物,故D错误;
故选B.
点评 本题考查反应热与焓变的应用,题目难度中等,明确焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量为解答关键,注意掌握化学反应与能量变化 的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.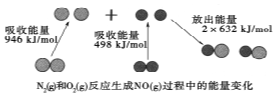 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 在1L的容器中发生反应,10min内 N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L•min) | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
11.分子式为C4H8O2的有机物有多种同分异构体,其中能发生银镜反应的共有(不考虑立体异构)( )
| A. | 2种 | B. | 7种 | C. | 10种 | D. | 12种 |
1.配制500mL 1mol•L-1的NaCl溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
8.某有机物的分子式为C4H8O2,有关其同分异构体数目的说法错误的是( )
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
5.下列有关说法正确的是( )
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
19.已知氢氟酸在水溶液中建立如下电离平衡:HF?H++F-,如只改变一个条件一定可以使c(HF)/c(H+)减小的是( )
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |