题目内容
20.溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
分析 若要使溴水的颜色变浅,可以通过改变条件使化学平衡向正反应方向移动,也可能加入能和溴发生反应的某些物质,结合溴的性质分析解答.
解答 解:A.该反应中没有气体参加或生成,改变加压对该平衡无影响,所以不能使溴水颜色变浅,故A错误;
B.加入氟化钠晶体,氢溴酸的酸性大于氢氟酸,所以氢溴酸和氟化钠反应,促进平衡向正反应方向移动,所以能使溴水颜色变浅,故B正确;
C.通入二氧化硫,溴具有强氧化性,在水溶液溴能氧化二氧化硫生成硫酸,自身被还原生成氢溴酸,所以能使溴水颜色变浅,故C正确;
D.加入NaI晶体,与溴水发生置换反应生成紫色的碘颜色变深,故D错误;
故选BC.
点评 本题考查了氧化还原反应、化学平衡移动,明确物质的性质及影响化学平衡移动的因素是解本题关键,易错选项是C,注意二氧化硫能和溴发生氧化还原反应而使化学平衡移动,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
18.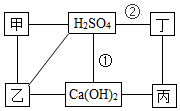 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |
8.雾霾天气中SO2是造成空气污染的主要原因;在硫酸工业生产过程中2SO2(g)+O2(g)?2SO3(g)是关键步骤.该反应的过程在600℃时的平衡常数K=19,有关的能量变化,实验数据如图所示.

(1)已知1mol SO2(g)氧化为1mol SO3(g)时的△H=-99kJ/mol.则图中△H=198 kJ/mol; E代表的意义是正反应活化能.结合表中的数据解释该反应是放热反应的原因:压强一定时,温度升高,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;若600℃时,在一密闭容器中,将二氧化硫和氧气混合,当测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,化学反应速率是v(正)> v(逆)(填“>”、“<”或“=”).
(2)硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3.已知在0.1mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).该溶液中c(H+)>c(OH-)(填“>”、“<”或“=”),简述理由(用简单的文字和离子方程式说明):NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于c(SO32-)>c(H2SO3),所以电离程度大于水解.
(3)有人设想用电化学原理生产硫酸(装置见图2),写出通入SO2的电极的电极反应式:SO2+2H2O-2e-=SO42-+4H+;为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29.

| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(2)硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3.已知在0.1mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).该溶液中c(H+)>c(OH-)(填“>”、“<”或“=”),简述理由(用简单的文字和离子方程式说明):NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于c(SO32-)>c(H2SO3),所以电离程度大于水解.
(3)有人设想用电化学原理生产硫酸(装置见图2),写出通入SO2的电极的电极反应式:SO2+2H2O-2e-=SO42-+4H+;为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29.
15.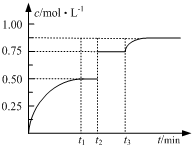 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
A(g)+B(g)?2C(g)+D(s)t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:A(g)+B(g)?2C(g)+D(s)t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 若t1=2,则反应在0~2 min内的平均速率为v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H>0 | |
| C. | 若t1时刻后向体系中加入A、B、C各1 mol,则υ(正)>υ(逆) | |
| D. | 温度不变,若起始向容器中加入1 mol A、1 mol B、2 mol D,则达平衡时A的转化率小于50% |
12.在空气中能稳定存在的物质是( )
| A. | 石灰水 | B. | 氯水 | C. | 次氯酸钠 | D. | 食盐水 |
10.下列反应的离子方程式正确的是( )
| A. | 镁片插入硝酸银溶液中:Mg+2Ag+═Mg2++2Ag | |
| B. | 常温下将氯气通入水中:Cl2+H2O?H++Cl-+HClO | |
| C. | 氯气与碘化钾溶液反应:Cl2+I-═2Cl-+I | |
| D. | 大理石加到盐酸中反应:CO32-+2H+═CO2↑+H2O |