题目内容
12.在空气中能稳定存在的物质是( )| A. | 石灰水 | B. | 氯水 | C. | 次氯酸钠 | D. | 食盐水 |
分析 A.石灰水能够吸收空气中二氧化碳反应生成碳酸钙;
B.氯水中次氯酸见光分解;
C.次氯酸钠能够吸收空气中二氧化碳和水;
D.氯化钠性质稳定;
解答 解:A.石灰水能够吸收空气中二氧化碳反应生成碳酸钙,所以石灰水不能在空气中稳定存在,故A错误;
B.氯水中次氯酸见光分解生成氯化氢和氧气而变质,所以氯水不能在空气中稳定存在,故B错误;
C.次氯酸钠能够吸收空气中二氧化碳和水生成次氯酸和碳酸钠而变质,所以氯水不能在空气中稳定存在,故C错误;
D.氯化钠性质稳定,能稳定存在与空气中,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉相关物质的性质及保存方法是解题关键,题目难度不大.

练习册系列答案
相关题目
20.溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
7.下列说法正确的是( )
| A. | 液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | SO2的水溶液能导电,所以SO2是电解质 | |
| C. | 蔗糖、酒精在水溶液里和熔融状态时均不导电,所以他们不是电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
17.下列物质中不能导电,又不是电解质和非电解质的是( )
| A. | 食盐溶 | B. | 石墨晶体 | C. | 液氯 | D. | 铜 |
1.下列反应的离子方程式错误的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
2.下列实验仪器,可用酒精灯直接加热的是( )
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
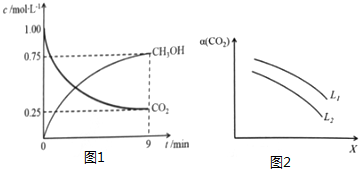 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如: