题目内容
10.下列反应的离子方程式正确的是( )| A. | 镁片插入硝酸银溶液中:Mg+2Ag+═Mg2++2Ag | |
| B. | 常温下将氯气通入水中:Cl2+H2O?H++Cl-+HClO | |
| C. | 氯气与碘化钾溶液反应:Cl2+I-═2Cl-+I | |
| D. | 大理石加到盐酸中反应:CO32-+2H+═CO2↑+H2O |
分析 A.二者反应生成硝酸镁和银;
B.二者反应生成氯化氢和次氯酸,次氯酸为弱酸,保留化学式;
C.电荷不守恒;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.镁片插入硝酸银溶液中,离子方程式:Mg+2Ag+═Mg2++2Ag,故A正确;
B.常温下将氯气通入水中,离子方程式:Cl2+H2O?H++Cl-+HClO,故B正确;
C.氯气与碘化钾溶液反应,离子方程式:Cl2+2I-═2Cl-+I2,故C错误;
D.大理石加到盐酸中反应,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故D错误;
故选:AB.
点评 本题考查了离子方程式的书写,明确离子反应实质及物质的性质是解题关键,注意离子反应遵循电荷守恒、原子个数守恒规律,注意化学式拆分,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
20.溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
1.下列反应的离子方程式错误的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
18.一定温度下,在4个容积均为1L的容器中分别进行反应(各容器中A都足量)A(s)+B(g)?C(g)+D(g)△H=+100kJ/mol,某时刻测得部分数据如表:下列说法正确的是( )
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
| A. | 容器Ⅳ中c(D)=0.4 mol/L | |
| B. | t2时容器Ⅱ中v(正)>v(逆) | |
| C. | 容器Ⅰ中平均反应速率v(B)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| D. | 容器Ⅲ中反应至平衡时吸热20 kJ |
15.某无色溶液中含有:①Na+、②Mg2+、③Cl-、④Br-、⑤OH-中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如表:
根据上述实验现象,判断以下结论中正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4,振荡,静置 | CCCl4层呈橙红色 |
| ③ | 取②上层溶液,加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 肯定含有的离子是①④⑤ | B. | 肯定没有的离子是②⑤ | ||
| C. | 可能含有的离子是①② | D. | 不能确定的离子是①③ |
2.下列实验仪器,可用酒精灯直接加热的是( )
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
5.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
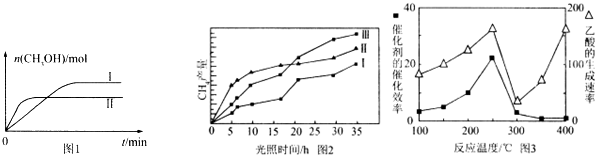 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
①曲线I、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1mol.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.①曲线I、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
6.标准状况下11.2L某烃A在一定的条件下,可与1g H2起加成反应生成通式为CnH2n的直链烃,将加成产物燃烧可得二氧化碳88g.下列可能为烃A名称的是( )
| A. | 2-甲基丙烷 | B. | 1,3-丁二烯 | C. | 2-甲基丙炔 | D. | 2-甲基丙烯 |