题目内容
18.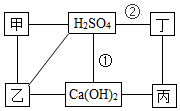 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |
分析 氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,和碳酸钠反应生成碳酸钡沉淀和氯化钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,稀硫酸和氢氧化钙反应生成硫酸钙和水,氢氧化钙和稀盐酸反应生成氯化钙和水,稀盐酸和镁反应生成氯化镁和氢气,镁和稀硫酸反应生成硫酸镁和氢气,所以甲、乙、丙、丁分别是BaCl2、Na2CO3、HCl和Mg,据此答题.
解答 解:氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,和碳酸钠反应生成碳酸钡沉淀和氯化钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,稀硫酸和氢氧化钙反应生成硫酸钙和水,氢氧化钙和稀盐酸反应生成氯化钙和水,稀盐酸和镁反应生成氯化镁和氢气,镁和稀硫酸反应生成硫酸镁和氢气,所以甲、乙、丙、丁分别是BaCl2、Na2CO3、HCl和Mg,
A.根据上面的分析可知,甲是BaCl2,故A错误;
B.根据上面的分析可知,乙是Na2CO3,故B错误;
C.反应①是硫酸和氢氧化钙发生发生的复分解反应,②是硫酸与Mgm的反应,是氧化还原反应,故C错误;
D.HCl和Mg反应生成氯化镁和氢气,Mg是还原剂,故D正确.
故选D.
点评 本题主要考查物质的性质,常见无机物的推断,题目难度中等,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
8.某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,中和反应都是放热反应,其实质是酸电离出的H+与碱电离出的OH-结合生成弱电解质水:H++OH-═H2O.
13.在可逆反应2NO2(g)?N2O4(g)中,下列可说明反应已达到平衡状态的是( )
| A. | NO2和N2O4浓度相等 | B. | NO2和N2O4分子数之比为2:1 | ||
| C. | 体系颜色不再发生变化 | D. | N2O4不再分解 |
3.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molH2O所含有的原子数为NA | |
| B. | 32gO2含有的氧原子数为2NA | |
| C. | 常温常压下,11.2 LCl2 所含的分子数为0.5NA | |
| D. | 1L0.1mol/LNaCl溶液中所含的Na+数为NA |
20.溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
1.下列反应的离子方程式错误的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如: