题目内容
17.某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+和Na+.某同学为了确定其组分,设计并完成了如下实验: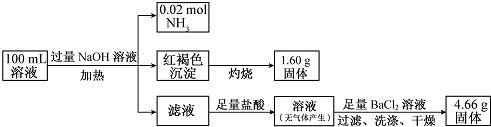
由此可推测原溶液中( )
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe3+,原溶液中一定没有CO32-;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子,由溶液为电中性可判断是否存在氯离子,以此来解答.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,为Fe3+,原溶液中一定没有CO32-;由于加入了NaOH,无法判断原溶液中是否含有Na+;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,由电荷守恒,原溶液中一定有Cl-,物质的量至少为 0.02mol×2+0.02mol-0.02mol×2=0.02mol,
A.原溶液中一定存在SO42-、NH4+、Cl-、Fe3+,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故A错误;
B.原溶液中一定存在SO42-、NH4+、Cl-、Fe3+,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
C.由以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+,所以正电荷物质的量为0.02mol×3+0.02mol=0.08mol,而负电荷的物质的量为0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.08mol-0.04mol}{0.1L}$=0.4mol•L-1,故C正确;
D.c(Fe3+)=$\frac{0.02mol}{0.1L}$=0.2mol•L-1,故D错误;
故选C.
点评 本题考查溶液中成分的确定,为高频考点,注意掌握常见离子的性质及检验方法为解答的关键,注意根据溶液电中性判断氯离子存在,侧重分析、推断能力的综合考查,题目难度中等.

| A. | 石油裂解 | B. | 石油的分馏 | ||
| C. | 石油的裂化 | D. | 甲烷和氯气混合后光照 |
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
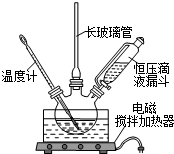 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:①

②
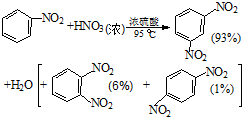
组装如图反应装置.有关数据列表如右下表:
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |
请回答:
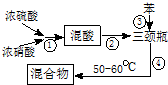
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入10mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.

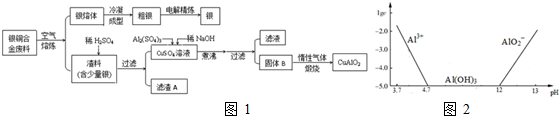
 配合物种类繁多,应用广泛.按要求完成下列各题:
配合物种类繁多,应用广泛.按要求完成下列各题: