题目内容
12.(1)某无色溶液可能含有下列离子中的几种:H+、Mg2+、Na+、Ag+、Cl-、OH-、HCO3-、NO3-,已知该溶液能和金属铝反应,放出的气体只有氢气.试推断:若溶液和铝反应后有AlO2-生成,则原溶液中一定大量含有的离子是OH-、Na+;还可能有较大量的离是Cl-、NO3-;若溶液和铝反应后有Al3+生成,则原溶液中一定不能大量含有的离子是Ag+、OH-、HCO3-、NO3-.(2)在含有Na+、Mg2+、HCO3-、SO42-的稀溶液中,它们的物质的量之比为2:1:2:1.
①向该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,有关反应的离子方程式为HCO3-+H2O?H2CO3+OH-.
②充分加热①步所得的溶液,加热的过程中观察到的现象有白色沉淀、产生气泡;有关反应的离子方程式为Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑.
(3)已知NaHSO4是一种酸式盐.
①NaHSO4溶液与NaHCO3溶液反应的离子方程式为:H++HCO3-═CO2↑+H2O.
②2mol/L的NaHSO4溶液与1mol/L的Ba(OH)2溶液等体积混合,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,若在反应后的溶液中继续滴加Ba(OH)2溶液,写出发生反应的离子方程式Ba2++SO42-=BaSO4↓.
分析 (1)跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析.
(2)①该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,因HCO3-水解生成OH-;
②充分加热①步所得的溶液,Mg2+、HCO3-反应生成氢氧化镁和二氧化碳,以此来解答;
(3)①NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳;
①2mol/L的NaHSO4溶液与1mol/L的Ba(OH)2溶液等体积混合溶液中性,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;
至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有AlO2-生成,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-;溶液和铝粉反应后有Al3+生成,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,
故答案为:OH-、Na+;Cl-、NO3-;Ag+、OH-、HCO3-、NO3-;
(2)①该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,因HCO3-水解生成OH-,水解离子反应为HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
②加热①步所得的溶液,Mg2+、HCO3-反应生成氢氧化镁和二氧化碳,观察到有白色沉淀、产生气泡,碱性减弱,为中性溶液,则溶液为无色,离子反应为Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑,故答案为:白色沉淀、产生气泡;Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑;
(3)①NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳,离子方程式:H++HCO3-═CO2↑+H2O,故答案为:H++HCO3-═CO2↑+H2O;
②NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,则离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查物质的检验及离子的共存问题,明确常见离子之间的反应、离子方程式的定量书写、溶液的酸碱性判断,为高频考点,把握水解原理及离子反应的书写方法为解答的关键,侧重水解反应的离子反应考查,题目难度不大.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
| A. | 烷烃分子中碳原子不可能在同一平面上 | |
| B. | 烷烃易被酸性高锰酸钾溶液氧化 | |
| C. | 在光照条件下,烷烃易与溴水发生取代反应 | |
| D. | 烷烃的卤代反应很难得到纯净的产物 |
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
(1)该实验结论是在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用.
(2)还可以控制变量,研究哪些因素对该反应速率的影响:温度、浓度等.
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论.请你写出实验①的现象并分析产生该现象的原因:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率.
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.
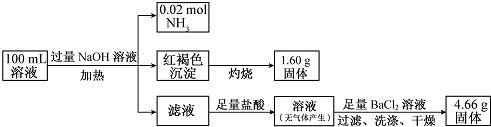
由此可推测原溶液中( )
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |
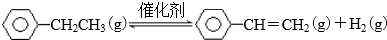
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]

①比较图中A、B两点对应平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2(用化学方程式表示)
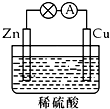
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
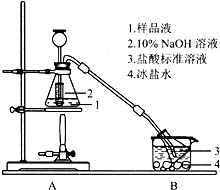 Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.
Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.