题目内容
13.下列框图涉及到的物质所含元素中,除一种元素外,其余均为短周期元素.
已知:A、F为无色气体单质,B为具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).请回答下列问题:
(1)A的构成元素在周期表中的位置为第二周期VIA族
(2)A与B反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)写出实验室制B的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(4)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-..
分析 E为红色金属单质,E为Cu,C为黑色氧化物,则C为CuO,B为具有刺激性气味的碱性气体,则B为NH3,A、F为无色气体单质,F与A放电生成D,其A与氨气反应生成D,D与A、水反应生成G,G与Cu反应生成D,可推知F为N2,A为O2,D为NO,G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,J、K是同种金属的不同氯化物,K为白色沉淀,应为CuCl.
解答 解:E为红色金属单质,E为Cu,C为黑色氧化物,则C为CuO,B为具有刺激性气味的碱性气体,则B为NH3,A、F为无色气体单质,F与A放电生成D,其A与氨气反应生成D,D与A、水反应生成G,G与Cu反应生成D,可推知F为N2,A为O2,D为NO,G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,J、K是同种金属的不同氯化物,K为白色沉淀,应为CuCl.
(1)A中元素为氧元素,位于周期表中第二周期VIA族,故答案为:第二周期VIA族;
(2)O2与NH3生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)实验室制氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)SO2还原CuCl2生成CuCl的离子方程式为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-.
点评 本题考查无机物的推断,题目难度中等,注意以E为解答该题的突破口,结合物质的转化关系进一步推断其它物质,学习中注意相关物质的性质的把握.

 名校课堂系列答案
名校课堂系列答案| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加的反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 能够自发进行的反应就一定能够发生并完成 |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为H2S,它的还原性比j的氢化物还原性强(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性弱(填“强”或“弱”).
(3)e单质的电子式为
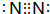 ,e的氢化物的结构式为
,e的氢化物的结构式为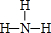 .
.(4)用电子式表示h与k构成化合物的形成过程

(5)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是AD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: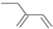 |

| A. | 分子式为C10H8O6 | |
| B. | 分子中含有3种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3mol NaOH发生中和反应 |
| A. | Cl2 | B. | NH4Cl | C. | C2H6 | D. | KOH |
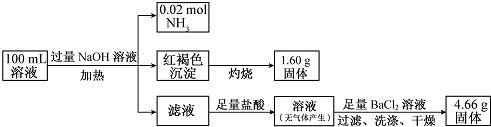
由此可推测原溶液中( )
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |

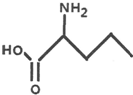 2-氨基戊酸
2-氨基戊酸 含有苯环结构的酯类化合物的同分异构体有6种,它们是:
含有苯环结构的酯类化合物的同分异构体有6种,它们是: 、
、 、
、
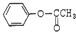 、
、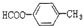 、
、 .
.