题目内容
5.某温度下,按照下表数据进行浓度对化学反应速率的影响的实验:(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
分析 时间越短说明反应速率越大,其他条件不变,改变其中一个条件,分析判断反应速率,图表中主要是改变了反应物的浓度对反应速率的影响,浓度越大反应速率越大,反应时间越短.
解答 解:(1)本实验是研究浓度对化学反应速率的影响,除浓度外,其他条件都要统一,实验①和③的总体积都是6mL,所以实验②中加3% Na2S2O3溶液的体积应该是6mL-2mL=4mL,故答案为:4;
(2)图表中主要是改变了反应物的浓度对反应速率的影响,浓度越大反应速率越大,反应时间越短,反应物浓度③>②>①则反应③速率最快,时间最短只有c 16s符合,故答案为:c;
(3)对于一个化学反应,在其他条件不变时,改变物质浓度对反应速率的影响是浓度越大反应速率越大,
故答案为:对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
点评 本题考查了影响化学反应速率因素的分析判断,主要是浓度改变对反应速率的实验探究,掌握基础和影响化学反应速率因素是关键,题目较简单.

练习册系列答案
相关题目
2.下列物质中,属于共价化合物的是( )
| A. | Cl2 | B. | NH4Cl | C. | C2H6 | D. | KOH |
19.乙酸乙酯在KOH溶液中水解,得到的产物是( )
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
6.下列关于烷烃性质的叙述正确的是( )
| A. | 烷烃分子中碳原子不可能在同一平面上 | |
| B. | 烷烃易被酸性高锰酸钾溶液氧化 | |
| C. | 在光照条件下,烷烃易与溴水发生取代反应 | |
| D. | 烷烃的卤代反应很难得到纯净的产物 |
10.某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
17.某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+和Na+.某同学为了确定其组分,设计并完成了如下实验:
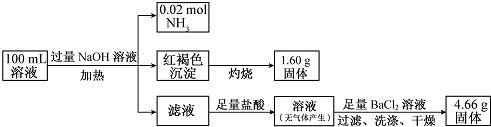
由此可推测原溶液中( )

由此可推测原溶液中( )
| A. | NH4+、Na+、SO42-一定存在,CO32--定不存在 | |
| B. | NH4+、SO42--定存在,CO32-、Na+-定不存在 | |
| C. | c(Cl-)至少为0.2 mol/L | |
| D. | c(Fe3+)一定为0.2 mol/L |

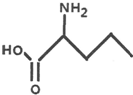 2-氨基戊酸
2-氨基戊酸 含有苯环结构的酯类化合物的同分异构体有6种,它们是:
含有苯环结构的酯类化合物的同分异构体有6种,它们是: 、
、 、
、
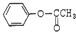 、
、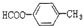 、
、 .
.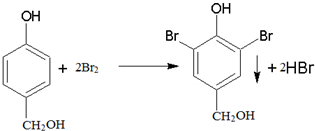 .
.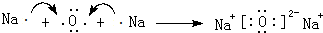 .
.