题目内容
1. 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:(1)锌电极为电池的负 极,发生的电极反应为Zn-2e-=Zn2+; 铜电极为正极,发生的电极反应为2H++2e-=H2↑.
(2)外电路中,电子的流向从Zn电极流向Cu电极;电流的流动方向由Cu电极流向Zn电极.
(3)当电路中转移0.2mol的电子时,消耗负极材料的质量为6.5g;生成氢气的物质的量为2.24L.(标准状况下)
分析 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池,Zn失电子作负极,Cu为正极,正极上氢离子得电子,电子从负极流向正极,电流从正极流向负极,结合电子与物质的关系计算.
解答 解:(1)根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池,Zn失电子作负极,负极反应为Zn-2e-=Zn2+;Cu为正极,正极上氢离子得电子生成氢气,则正极反应为2H++2e-=H2↑;
故答案为:负;Zn-2e-=Zn2+;正;2H++2e-=H2↑;
(2)外电路中,电子的流向从Zn电极向Cu电极;电流的流动方向由Cu电极流向 Zn电极;
故答案为:Zn;Cu;Cu;Zn;
(3),负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,当电路中转移0.2mol的电子时,消耗的Zn为0.1mol,则锌的质量为6.5g,生成的氢气为0.1mol,其体积为2.24L;
故答案为:6.5g;2.24L.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式为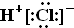 | B. | Cl-的结构示意图 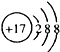 | ||
| C. | CO2的电子式 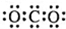 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
12.下列电离方程式正确的是( )
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | KHCO3?K++H+++CO3- | D. | CH3COONH4=NH4++CH3COO- |
9.下列过程一定释放能量的是( )
| A. | 化合反应 | B. | 分解反应 | ||
| C. | 反应物分子中化学键断裂 | D. | 原子组合成分子 |
16.下列元素中非金属性最强的是( )
| A. | O | B. | F | C. | S | D. | Cl |
6.下列各分子中所有原子都满足最外层为8电子稳定结构的是( )
| A. | BeCl2 | B. | CO2 | C. | HCl | D. | N2 |
13.将含一种杂质(其质量小于0.3g)的丙醛试样8g,与足量的银氨溶液反应,析出银30.6g,则该杂质可能是( )
| A. | 甲醛 | B. | 乙醛 | C. | 丁醛 | D. | 戊醛 |
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题: