题目内容
11. 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:(1)如图是干电池的基本构造图,干电池工作时正极上的反应是NH4++e-=NH3+$\frac{1}{2}$H2,则负极上的电极反应式是Zn-2e-═Zn2+,MnO2的作用是除去正极上生成的氢气,本身生成Mn2O3,该反应的化学方程是2MnO2+H2═Mn2O3+H2O.
(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中.
(3)氯化铵、氯化锌的提取、分离和检验
①向黑色粉末中加入一定量的蒸馏水充分搅拌溶解,过滤,将滤液蒸发浓缩、冷却结晶,再过滤,所得晶体即为ZnCl2和NH4Cl的混合物;
②用加热法可以将NH4Cl和ZnCl2的晶体混合物分离开;
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:取少许晶体配成溶液,分为两份,一份逐滴滴加NaOH溶液至过量,另一份逐滴滴加氨水至过量,两溶液中均出现先产生白色沉淀,后沉淀都溶解的现象.(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主Ⅰ要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质.
分析 (1)锌锰干电池中,锌作为负极,失去电子;MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气;
(2)②根据NH4Cl易分解的性质选取分离方法;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解.
解答 解:(1)在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn-2e-=Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为2MnO2+H2=Mn2O3+H2O,
故答案为:Zn-2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
(3)②NH4Cl具有热不稳定性,而且稳定性降低时又能马上化合生成氯化铵,因此可以采用加热方法,
故答案为:加热;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解,Zn(OH)2也能溶解于氨水,则取少许晶体配成溶液,分为两份,一份逐滴滴加NaOH溶液至过量,另一份逐滴滴加氨水至过量,两溶液中均出现先产生白色沉淀,后沉淀都溶解的现象,说明ZnCl2晶体中含Zn2+;
故答案为:取少许晶体配成溶液,分为两份,一份逐滴滴加NaOH溶液至过量,另一份逐滴滴加氨水至过量,两溶液中均出现先产生白色沉淀,后沉淀都溶解的现象.
点评 本题是以实验为主的综合题,考查物质的提取、分离、检验及电化学知识,题目较为综合,题目难度中等,学习中注意化学实验知识的积累,侧重于考查学生的实验探究能力和分析应用能力.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
19.如图1所示:将30mL 0.1mol•L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol•L-1第三周期某元素形成的酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.下列说法正确的是( )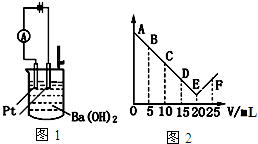

| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
6.在常温下,将VmL0.05mol.L-1的醋酸溶液缓慢滴加到10mol0.05mol•L-1的Na2CO3溶液中,并不断搅拌(气体完全逸出),所得溶液中微粒的物质的量浓度关系正确的( )
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示: 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
 .
.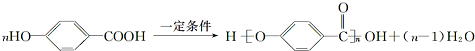 .
.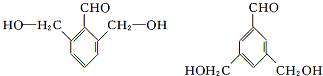 (任意一种).
(任意一种).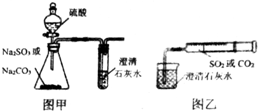 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.