题目内容
12.下列电离方程式正确的是( )| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | KHCO3?K++H+++CO3- | D. | CH3COONH4=NH4++CH3COO- |
分析 A.氯化铵为盐,属于强电解质完全电离用等号;
B.硫化氢为多元弱酸,分步电离,以第一步为主;
C.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
D.醋酸铵为盐,属于强电解质,完全电离,用等号;
解答 解:A.氯化铵为盐,属于强电解质完全电离用等号,电离方程式:NH4Cl=NH4++Cl-,故A错误;
B.硫化氢为多元弱酸,分步电离,以第一步为主,电离方程式:H2S?H++HS-,故B错误;
C.碳酸氢钾为强电解质完全电离,应等号,碳酸氢根离子为多元弱酸的酸式根离子,不能拆,碳酸氢钾电离方程式:KHCO3=K++HCO3-,故C错误;
D.醋酸铵为盐,属于强电解质,完全电离,用等号,电离方程式:CH3COONH4=NH4++CH3COO-,故D正确;
故选:D.
点评 本题考查了电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意多元弱酸分步电离,以第一步为主,多元弱酸根离子不能拆,题目难度不大.

练习册系列答案
相关题目
7.某同学利用如图1装置探究温度对化学平衡的影响,已知烧瓶中存在如下平衡:2NO2?N2O4△H<0.当进行图2实验后,以下结论正确的是( )
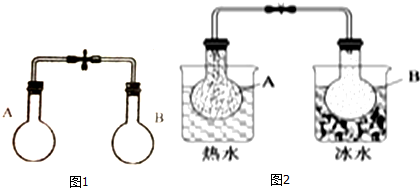

| A. | 图2中,B烧瓶颜色较深 | |
| B. | 图2中,B烧瓶与A烧瓶相比有较多的NO2 | |
| C. | 图2中B烧瓶的正反应速率比图1中B烧瓶的快 | |
| D. | 图2中A烧瓶的正反应速率比图1中A烧瓶的快 |
17.下列物质属于弱电解质的是( )
| A. | CO2 | B. | 氯水 | C. | NH3•H2O | D. | Ba(OH)2 |
4.为了鉴别乙烯、甲苯、苯酚溶液、乙醇溶液四种无色的液体,可以使用下列试剂合理的一组是( )
| A. | KMnO4酸性溶液 | B. | 银氨溶液 | ||
| C. | 溴水 | D. | 新制Cu(OH)2和FeCl3溶液 |
2.下列说法正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
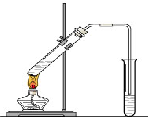 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O
CH3COOC2H5+H2O
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示: