题目内容
10.物质的量浓度为18.4mol/L的浓硫酸(密度为1.84g/cm3)与Cu反应生成气体2.24L(标准状况).(1)求被还原的硫酸的物质的量?
(2)配制100mL3.68mol/L的稀硫酸需上述浓硫酸多少?
分析 (1)反应生成的气体为二氧化硫,而被还原的硫酸生成二氧化硫,根据硫原子守恒计算;
(2)由稀释定律,稀释前后溶质硫酸的物质的量不变.
解答 解:(1)反应生成的气体为二氧化硫,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,而被还原的硫酸生成二氧化硫,根据硫原子守恒,可知被还原的硫酸的物质的量为0.1mol,
答:被还原硫酸的物质的量为0.1mol;
(2)由稀释定律,稀释前后溶质硫酸的物质的量不变,可知需要浓硫酸的体积为$\frac{100mL×3.68mol/L}{18.4mol/L}$=20.0mL,
答:需要浓硫酸的体积为20.0mL.
点评 本题考查氧化还原反应计算、物质的量浓度有关计算,比较基础,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol•L-1 Na2CO3溶液中,含CO${\;}_{3}^{2-}$数目小于NA | |
| B. | 1mol FeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
5.下列关于同分异构体数目的叙述不正确的是( )
| A. | 分子式为C5H12的烃有3种同分异构体 | |
| B. | 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种 | |
| C. | 含有5碳原子的饱和链烃,其一氯代物只有3种 | |
| D. | 菲的结构为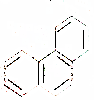 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
15.化学与社会、生活密切相关,对下列蔑象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 常温下,在足量的浓、稀硝酸中分别加入相同的铝片,浓硝酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | 乙酸乙酯是非电解质,它不能导电,它的水解产物乙酸是电解质(弱酸) |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含Cu2+的溶液中置换出铜 |
2.下列说法正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
19.如图1所示:将30mL 0.1mol•L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol•L-1第三周期某元素形成的酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.下列说法正确的是( )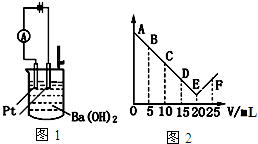

| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示: