题目内容
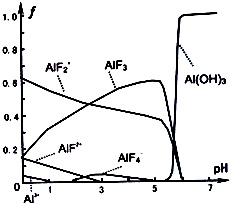
16.下列叙述正确的是( )| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |
分析 A.最高价含氧酸的酸性最强的元素为Cl;
B.O、F没有正价;
C.比较非金属性,应用最高价含氧酸;
D.离子化合物再熔融状态下可电离.
解答 解:A.最高价含氧酸的酸性最强的元素为Cl,F没有含氧酸,位于周期表的最右上方的为He,故A错误;
B.O、F没有正价,故B错误;
C.比较非金属性,应用最高价含氧酸,元素的非金属性越强,对应的最高价含氧酸的酸性越强,故C错误;
D.离子化合物再熔融状态下可电离,可导电,故D正确.
故选D.
点评 本题考查元素周期表及应用,为高频考点,把握元素在周期表的位置、元素的性质为解答的关键,注意元素性质的特例及元素位置与性质的关系,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
6.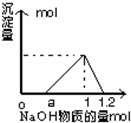 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )| A. | 1:3 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
4.下列离子方程式正确的是( )
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
1.某溶液中含有HCO3-、SO32-、CO32-和NO3-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
8.下列说法都正确的是( )
| A. | 某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,说明原溶液中一定含SO42- | |
| B. | 将含有SO2杂质的CO2气体,缓慢通过足量的高锰酸钾溶液,再通过浓硫酸干燥,可获得较纯净的CO2气体 | |
| C. | 某钠盐(含NaHCO3、Na2CO3中的一种或两种)试样0.168 g,将其灼烧,冷却,并用托盘天平称量残留固体的质量,根据质量是否变化,可确定样品的组成 | |
| D. | 铝热反应可生成铁,工业上可大量利用该反应来生产铁 |
 ⑤-CHO.
⑤-CHO.