题目内容
11.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是氟化氢是共价化合物,纯液态时不电离,因而不导电;
但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2-放电产生气体的电极反应式HF2--2e-=F2↑+H+.
(2)利用化学反应也能制取氟:K2MnF6+SbF5→KSbF6+MnF3+F2↑(未配平);其中还原产物是MnF3.如果生成该还原产物33.6克,则反应中转移电子数目为1.806×1023或0.3NA.
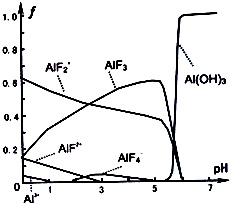
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图示.用NaOH溶液使混合液的PH从5调整到7,写出有关反应的离子方程式:3AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-.
分析 (1)氟化氢是共价化合物,纯液态时不导电;KHF2是离子化合物,熔融状态电离出阴阳离子而导电,且电解熔融态KHF2时,阳极上HF2-失电子生成氟气和氢离子;
(2)K2MnF6+SbF5→KSbF6+MnF3+F2↑(未配平)中Mn元素化合价由+4价变为+3价、F元素化合价由-1价变为0价,所以K2MnF6是氧化剂,K2MnF6对应的产物是还原产物;
该反应中转移电子数为2,根据MnF3和转移电子之间的关系式计算转移电子数;
(3)根据图知,pH从5到7,AlF2+、AlF3都和NaOH反应生成Al(OH)3,且同时生成氟离子.
解答 解:(1)氟化氢是共价化合物,纯液态时不发生电离,以分子存在,所以纯液态不导电;KHF2是离子化合物,熔融状态电离出阴阳离子而导电,且电解熔融态KHF2时,阳极上HF2-失电子生成氟气和氢离子,电极反应式为HF2--2e-=F2↑+H+,
故答案为:氟化氢是共价化合物,纯液态时不电离,因而不导电;HF2--2e-=F2↑+H+;
(2)K2MnF6+SbF5→KSbF6+MnF3+F2↑(未配平)中Mn元素化合价由+4价变为+3价、F元素化合价由-1价变为0价,所以K2MnF6是氧化剂,K2MnF6对应的产物MnF3是还原产物;
该反应中转移电子数为2,n(MnF3)=$\frac{33.6g}{112g/mol}$=0.3mol,根据MnF3和转移电子之间的关系式得转移电子物质的量为0.3mol,转移电子数为1.806×1023或0.3NA;
故答案为:MnF3;1.806×1023或0.3NA;
(3)根据图知,pH从5到7,AlF2+、AlF3都和NaOH反应生成Al(OH)3,且同时生成氟离子,离子方程式为3AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案为:3AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-.
点评 本题考查氧化还原反应计算、离子方程式的书写,为高频考点,侧重考查学生分析计算及判断能力,注意:电解质不一定导电,难点是(3)题离子方程式的书写,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CH2═CH2+HCl $→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. | 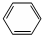 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ 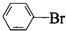 +HBr +HBr | |
| D. | CH3CH2 Br+NaOH $→_{△}^{乙醇}$ CH2=CH2↑+Na Br+H2O |
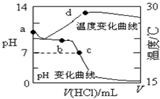 室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点时c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| C. | c点时消耗的盐酸体积:V(HCl)<20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |

| A. | 甲图中的小黑点疏密表述电子在核外空间出现机会的大小 | |
| B. | 甲图中的每个小黑点表示1个电子 | |
| C. | 乙图表示1s电子只能在球体内出现 | |
| D. | 乙图表明1s轨道呈圆形,有无数对称轴 |
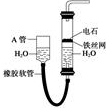 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔.