题目内容
14.已知物质A、B、C有如下转化关系:A$→_{①}^{氧化}$B$→_{②}^{氧化}$C
(1)若A是含氢量最高的烃,则过量的C与NaOH反应的离子方程式为CO2+OH-=HCO3-.
(2)若A是NH3,则B是NO C是NO2,反应①的化学方程式为:4NH4+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(3)若A是乙醇,同时反应②的氧化剂是新制Cu(OH)2悬浊液,写出反应②化学方程式:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
分析 A发生氧化反应生成B,B发生氧化反应生成C,
(1)若A是含氢量最高的烃,则A是CH4,甲烷发生氧化反应生成CO、CO发生氧化反应生成CO2,所以C是二氧化碳,二氧化碳属于酸性氧化物,过量二氧化碳和NaOH反应生成碳酸氢钠;
(2)如果A是氨气,氨气被氧化生成NO,NO被氧化生成NO2,所以B是NO、C是NO2,氨气被催化氧化生成NO和水;
(3)如果A是乙醇,同时反应②的氧化剂是新制Cu(OH)2悬浊液,则B是CH3CHO、C是CH3COONa,
据此分析解答.
解答 解:A发生氧化反应生成B,B发生氧化反应生成C,(1)若A是含氢量最高的烃,则A是CH4,甲烷发生氧化反应生成CO、CO发生氧化反应生成CO2,所以C是二氧化碳,二氧化碳属于酸性氧化物,过量二氧化碳和NaOH反应生成碳酸氢钠,离子方程式为CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-;
(2)如果A是氨气,氨气被氧化生成NO,NO被氧化生成NO2,所以B是NO、C是NO2,氨气被催化氧化生成NO和水,反应方程式为4NH4+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NO;NO2;4NH4+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)如果A是乙醇,同时反应②的氧化剂是新制Cu(OH)2悬浊液,则B是CH3CHO、C是CH3COONa,乙醛和新制氢氧化铜、NaOH溶液反应方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,
故答案为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
点评 本题考查物质推断,为高频考点,侧重考查学生分析推断能力,明确元素化合物性质、物质之间的转化是解本题关键,熟练掌握元素化合物性质并总结归纳,题目难度不大.

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |
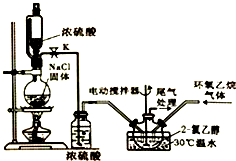 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.反应原理为:
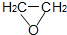 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0部分实验药品及物理量:
| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
(1)装置中使用恒压分液漏斗的优点是平衡气压,使分液漏斗内的液体能顺利滴下.
(2)在步骤④中,采用减压分馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解.
(3)写出实验步骤中提高环氧乙烷利用率的措施:氯化氢过量、反应温度控制在30℃.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是cabde.(选填序号)
②操作d加入硝基苯的目的是防止在滴加NH4CSN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则所测样品中Cl元素含量将会偏小.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的C.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为80.50%.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.

| A. | 甲图中的小黑点疏密表述电子在核外空间出现机会的大小 | |
| B. | 甲图中的每个小黑点表示1个电子 | |
| C. | 乙图表示1s电子只能在球体内出现 | |
| D. | 乙图表明1s轨道呈圆形,有无数对称轴 |
试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
| 实验方案(只要求填写选用试剂) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 实验现象 | 针对方程式①②或③试管中先生成白色沉淀,后白色沉淀消失. 针对方程式④:试管中有白色沉淀. | 溶液由浅黄绿色变成橙黄色 |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 19.4 g |