题目内容
14.某研究小组探究SO2和Fe(NO3)3溶液的反应.请回答:
(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气.
(2)装置B中产生了白色沉淀,其成分是BaSO4.
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;
假设3:Fe3+、NO3-同时氧化SO2.
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容.
| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.
分析 (1)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(2)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;Fe3+和NO3-都具有氧化性,都可与二氧化硫反应;
(3)验证在酸性条件下SO2与NO3-反应,配制与B溶液中相同pH的稀硝酸与BaCl2的混合液,为排除空气的干扰,通入适当的N2,再通入SO2于上述溶液中,若出现白色沉淀则假设2成立,若不出现白色沉淀则假设2不成立,据此分析;
(4)若假设1、假设2都成立,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+,不能证明假设3.
解答 解:(1)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
故答案为:排尽装置内的空气;
(2)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;则假设3为Fe3+、NO3-同时氧化SO2;
故答案为:BaSO4;Fe3+、NO3-同时氧化SO2;
(3)验证在酸性条件下SO2与NO3-反应,配制与B溶液中相同pH的稀硝酸与BaCl2的混合液,为排除空气的干扰,通入适当的N2,再通入SO2于上述溶液中,若出现白色沉淀则假设2成立,若不出现白色沉淀则假设2不成立;假设2成立,则说明在酸性条件下SO2与NO3-反应,验证过程中发生的离子方程式是:4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+;
故答案为:①pH;②pH;N2;4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+;
(4)若假设1、假设2都成立,但是未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+,不能确定原溶液中二氧化硫被谁氧化,故不能证明假设3;
故答案为:否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.
点评 本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
| A. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| C. | 向苯酚钠溶液中通入少量CO2: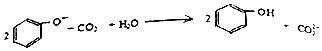 | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
| A. | 化学反应的能量变化只表现为反应放热或吸热两种形式 | |
| B. | 一个反应的反应物总能量大于生成物总能量,则该反应的焓变一定小于零 | |
| C. | 燃烧热的大小与热化学方程式中可燃物计量系数成正比 | |
| D. | 含1mol硫酸的稀溶液与足量NaOH稀溶液反应生成水所放出的热量为中和热 |
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101kPa下氢气的燃烧热△H=-285.8 kJ•mol-1,则水分解的热化学方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,则任何强酸和强碱发生中和反应生成1molH2O(l)的反应热均为-akJ•mol-1 | |
| D. | 1g甲烷完全燃烧生成液态水的过程中放出55.6kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
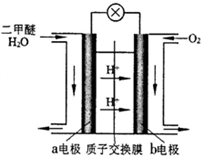 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下: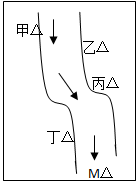 在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.
在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.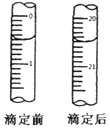 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下: