题目内容
4. 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol•L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O;
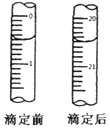
⑤用0.0020mol•L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是B C
A.H2C2O4溶液中:c(H+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,c(NH4+)前者小于后者
C.(NH4)2C2O4溶液中:c(NH4+)+c(NH3•H2O)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是反应生成的Mn2+催化了反应的进行,使褪色速率变快
(3)12.00mL0.0010mol•L-1的KMnO4溶液应用酸式滴定管 量取(填“酸式”或“碱式”滴定管)
(4)到达滴定终点时的现象是最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将偏低 (填“偏高”、“偏低”或“无影响”).
(6)计算血样中Ca2+的含量0.040 g/100mL.
分析 (1)A.H2C2O4溶液中存在电荷守恒,草酸分步电离;
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根离子水解促进铵根离子水解,亚铁离子水解抑制铵根离子水解;
C.(NH4)2C2O4溶液中存在物料守恒;
D.(NH4)2Fe(SO4)2溶液中铵根离子水解减小,亚铁离子浓度小于铵根离子浓度,溶液中铵根离子和亚铁离子水解显酸性:
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,说明反应生成的锰离子对反应有催化作用;
(3)高锰酸钾溶液具有强氧化性,能腐蚀橡胶管;
(4)到达滴定终点时的现象是滴入最后一滴,溶液紫红色褪去且半分钟不恢复证明反应达到反应终点;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,消耗标准(NH4)2Fe(SO4)2溶液体积增大,则与草酸反应的高锰酸钾溶液体积减小,测定钙离子浓度偏低;
(6)2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,结合反应定量关系,计算过量的KMnO4的物质的量,从而得到与H2C2O4反应的KMnO4的物质的量,5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,据此计算钙离子含量.
解答 解:(1)A.H2C2O4分步电离,溶液中存在电荷守恒,c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A错误;
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根离子水解促进铵根离子水解,亚铁离子水解抑制铵根离子水解,c(NH4+)前者小于后者,故B正确;
C.(NH4)2C2O4溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),故C正确;
D.(NH4)2Fe(SO4)2溶液中铵根离子水解减小,亚铁离子浓度小于铵根离子浓度,:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故D错误;
故答案为:B C;
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,说明反应生成的锰离子对反应有催化作用,反应生成的Mn2+催化了反应的进行,使褪色速率变快,
故答案为:反应生成的Mn2+催化了反应的进行,使褪色速率变快;
(3)高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,12.00mL0.0010mol•L-1的KMnO4溶液应用酸式滴定管,
故答案为:酸式滴定管;
(4)到达滴定终点时的现象是滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色,说明反应达到终点,
故答案为:最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,消耗标准(NH4)2Fe(SO4)2溶液体积增大,过量的KMnO4溶液体积增大,与草酸反应的高锰酸钾物质的量减小,则和草酸钙反应的测得血液中Ca2+的含量将偏低,
故答案为:偏低;
(6)KMnO4的总物质的量为:0.0010 mol•L-1×12×10-3L=1.2×10-5 mol,
2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,结合反应定量关系得到:滴定终点消耗(NH4)2Fe(SO4)2溶液体积读取得到20.00ml,
MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,
1 5
n 0.02000L×0.0020mol•L-1
n=8×10-6mol,
与H2C2O4反应的KMnO4的量为:1.2×10-5 mol-8.0×10-6 mol=4.0×10-6 mol,
5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,
5 2
n 4×10-6mol
n(Ca2+)=1×10-5mol
准确量取5.00mL血液样品,处理后配制成50.00mL溶液中含钙离子物质的量=1×10-5mol×$\frac{50}{10}$=5×10-5mol,
l00mL血液中含Ca2+的质量=$\frac{100}{5}$×5×10-5mol×40g/mol=0.040g,
故答案为:0.040.
点评 本题考查了弱电解质电离、电解质溶液中守恒关系的分析判断、离子反应方程式的书写以及计算、滴定实验过程的理解应用,综合性较强,正确书写离子反应方程式是计算的关键,题目难度中等.


(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气.
(2)装置B中产生了白色沉淀,其成分是BaSO4.
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;
假设3:Fe3+、NO3-同时氧化SO2.
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容.
| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.
| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③水分子稳定性好是因水分子间含有氢键
④非金属单质中一定存在共价键
⑤由非金属元素组成的化合物一定是共价化合物
⑥化学反应中一定有化学键断裂,同时也有化学键形成
⑦盐酸中含有H+和Cl-,所以HCl是离子化合物( )
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |