题目内容
5.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.物质的量=$\frac{m}{M}$,氯气由氯原子构成;
C.氖气为单原子分子;
D.在同温同压时,相同体积的任何气体单质的物质的量相同.
解答 解:A.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,故分子个数小于0.5NA个,故A错误;
B.氯气由氯原子构成,故71g氯气中含有的氯原子的物质的量为n=$\frac{71g}{35.5g/mol}$=2mol,即为2NA个,故B错误;
C.氖气为单原子分子,故1mol氖气中含1mol氖原子即NA个,故C正确;
D.在同温同压时,相同体积的任何气体单质的物质的量相同,但由于气体单质分为单原子分子、双原子分子和多原子分子,故含有的原子个数不一定相同,故D错误,
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域.下列有关叙述正确的是( )
| A. | 14C与12C是两种不同的元素或核素 | |
| B. | 通过化学变化可以实现16O与18O之间的相互转化 | |
| C. | 35Cl2与37Cl2互为同素异形体 | |
| D. | 铯元素的两种同位素中137Cs比133Cs多4个中子 |
16.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
13.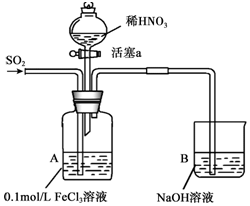 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如表:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如表:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
20.下列有关描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气 | |
| C. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
10.一定温度下容积恒定的密闭容器中,有可逆反应:2NO2(g)?N2O4(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
14.某研究小组探究SO2和Fe(NO3)3溶液的反应.请回答:

(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气.
(2)装置B中产生了白色沉淀,其成分是BaSO4.
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;
假设3:Fe3+、NO3-同时氧化SO2.
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容.
经验证假设2成立,则验证过程中发生的离子方程式是4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+.
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.

(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气.
(2)装置B中产生了白色沉淀,其成分是BaSO4.
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;
假设3:Fe3+、NO3-同时氧化SO2.
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容.
| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.
15.下列各组试剂中.能用如图所示实验装置进行配备和收集气体的一组是( )
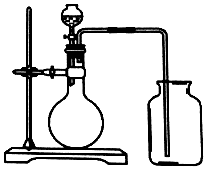

| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |