题目内容
4. 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).该反应的△H=-246.1kJ/mol.催化反应室中采用300℃的反应温度,理由是保证催化剂的活性最大,提高化学反应速率.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将逆向进行(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为蒸馏.
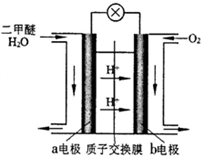
(4)如图为绿色电源“二甲醚燃料电池”的工作原理示意图.该电池工作时,H+向正极移动(填“正”或“负”);a电极的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
分析 (1)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产;
(2)计算浓度商Qc,Qc=k,处于平衡状态;Qc>k,向逆反应进行;Qc<k,向正反应进行;
(3)分离沸点相差较大的互溶液体,常用方法是蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,氢离子移向b电极,a极为负极,二甲醚放电生成二氧化碳与氢离子.
解答 解:(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的(保证催化剂的活性最大),提高化学反应速率,
故答案为:-246.1kJ/mol;保证催化剂的活性最大,提高化学反应速率;
(2)该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时c(CO)=1mol/L,c(H2)=1.5mol/L,c(CH3OH)=1mol/L,浓度商Qc=$\frac{1}{1×1.{5}^{2}}$=0.44,大于平衡常数0.27,故反应向逆反应进行,
故答案为:逆向进行;
(3)二甲醚、乙醇、水为互溶的液体,沸点不同,采取蒸馏的方法将二甲醚分离,
故答案为:蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,氢离子移向b电极,b电极正极,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+.
点评 本题综合性较大,涉及反应热、化学平衡、原电池、实验基本操作等,难度中等,(4)中电极反应式书写是易错点,可以先写出正极电极反应式,利用总反应式减正极反应式即为负极反应式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 14C与12C是两种不同的元素或核素 | |
| B. | 通过化学变化可以实现16O与18O之间的相互转化 | |
| C. | 35Cl2与37Cl2互为同素异形体 | |
| D. | 铯元素的两种同位素中137Cs比133Cs多4个中子 |
| A. | A.运石油的油罐车上应贴  标志,并由专人押运 标志,并由专人押运 | |
| B. | 不慎将酒精洒到桌面上引起着火,可用水扑灭 | |
| C. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用硼酸稀溶液冲洗 | |
| D. | 右图装置可分离CH3COOC2H5和碳酸钠饱和溶液 |
| A. | 汗水的挥发 | B. | 蛋白质的水解 | C. | 葡萄糖的氧化 | D. | 油脂的消化吸收 |
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
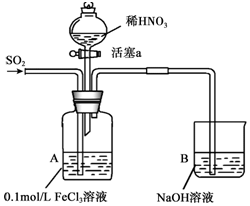 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如表:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.

(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是排尽装置内的空气.
(2)装置B中产生了白色沉淀,其成分是BaSO4.
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;假设2:在酸性条件下SO2与NO3-反应;
假设3:Fe3+、NO3-同时氧化SO2.
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容.
| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由否,未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+.
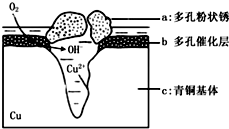 图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.
图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.