题目内容
19.根据下列热化学方程式:(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1;
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1;
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
分析 依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关,
已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到.
解答 解:已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol
故选B.
点评 本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单,掌握基础是解题关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
10.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
7.下列各组离子在指定溶液中可能大最共存的是( )
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
11.下列通过试剂间两两反应不能鉴别的是( )
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
8.硫代硫酸钠溶液与稀硫酸的反应为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,某兴趣小组以该反应为例探究反应速率的影响因素并设计了如下实验,下列说法不正确的是( )
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
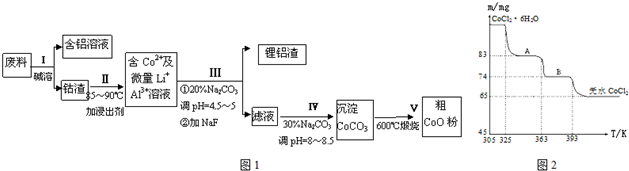
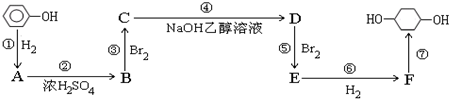
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;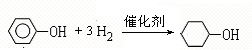 ;
;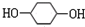 +2NaBr.
+2NaBr.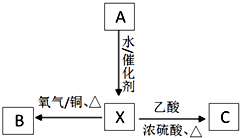 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答: